1. Introduction
La chirurgie chez les malades atteints de tétralogie de Fallot a radicalement transformé leur vie. La plupart des opérés vont vivre longtemps et mener une vie quasiment normale, bien qu'ils soient exposés à un certain nombre de problèmes. Il faut se souvenir que la correction chirurgicale définitive n'est jamais une vraie correction complète car elle ne restitue pas une anatomie cardiaque tout à fait normale, dans le sens que la voie de chasse droite demeure anormale : il y a généralement un certain degré de sténose pulmonaire résiduelle et une insuffisance pulmonaire. Parfois, ces lésions résiduelles sont si importantes qu'elles nécessitent une réintervention.
L'évolution lointaine après opération a fait l'objet de plusieurs rapports (1, 2, 3). Tous constatent qu'il y a une mortalité tardive certes faible, mais non négligeable. La première cause de décès tardif est la mort subite. La mort subite frappe une minorité des opérés (1 à 3 %), elle est sans doute liée aux troubles du rythme post-opératoire, notamment la tachycardie ventriculaire et la fibrillation ventriculaire (1, 3). Des troubles de la conduction peuvent également en être responsables. Sachant de 40 à 50 % des opérés arrivant à l'adolescence présentent au Holter des troubles du rythme ventriculaire de degré II ou plus selon Lown (1, 4, 5), la question suivante se pose : faut-il traiter à vie la moitié des patients opérés, dans le but d'éviter une mort subite, qui demeure un événement rare ?. La réponse est évidemment non, et pourtant, l'identification des patients à risque de mort subite avant leur premier épisode rythmique pourrait leur sauver la vie.
Plusieurs études ont été réalisées dans le but de détecter les patients susceptibles d'être atteints par ces événements dramatiques, études où on a cherché les moyens de traiter précocement les patients à risque d'arythmies ventriculaires dangereuses. D'une façon générale, les méthodes utilisées pour détecter l'instabilité électrique ventriculaire ont été les suivantes :
-
des signes directs sur l'électro-cardiogramme de surface (4)
-
un test d'effort (4)
-
l'enregistrement de l'ECG de 24 heures (Holter) (4)
-
l'étude électrophysiologique invasive et la stimulation ventriculaire programmée. En raison du caractère invasif de cette méthode et de son coût élevé, elle ne peut pas être proposée de façon systématique. On préfère en général les techniques non invasives (6)
-
la recherche de potentiels tardifs, mis en évidence par l'électro-cardiogramme à haute amplification et, plus récemment, la dispersion de l'espace QT, méthode non invasive qui semble contribuer à évaluer le risque d'arythmie (7).
1.1 L'électrocardiogramme à haute amplification
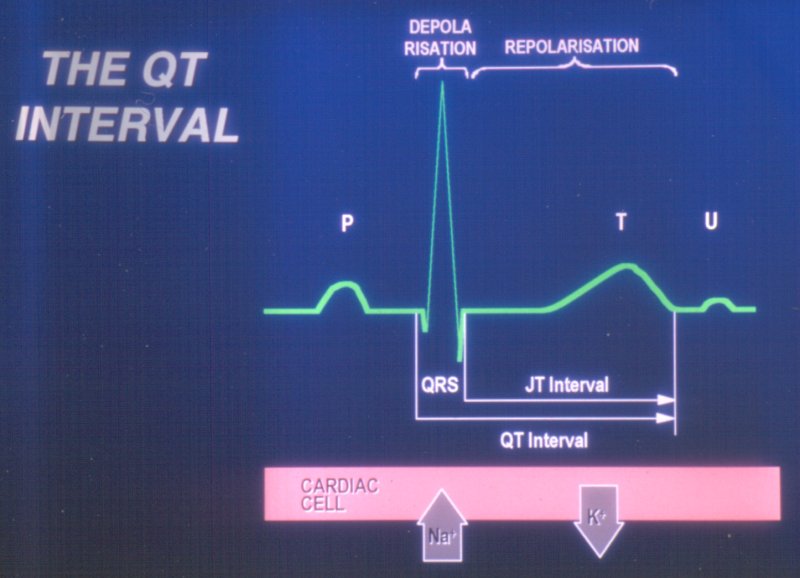
L'électro-cardiogramme à haute amplification (ECG HA) est une méthode bien connue depuis plus d'une décennie. A la différence de l'ECG standard de surface, elle permet de recueillir des événements électriques de haute fréquence, et de très basse amplitude, de l'ordre de quelques microvolts, à la fin du complexe QRS, appelés 'potentiels tardifs' (8, 9). Leur incidence chez les sujets normaux varie entre 0 et 7 %. Ces potentiels tardifs représentent des zones myocardiques de conduction lente et sont ainsi considérés comme des substrats d'arythmie ventriculaire par réentrée (8).
1.1.1 Méthodologie de l'ECG HA
L'analyse dans le domaine temporel reste la méthode la plus utilisée en pratique. L'acquisition des données par 3 dérivations orthogonales bipolaires x, y et z, les dérivations de Frank, donne des informations plus précises en tenant compte de la distribution spatiale du vecteur électrique cardiaque et de la position du coeur dans le thorax.
La première étape est la détection et l'alignement des complexes QRS dans le but d'éliminer les extra-systoles ventriculaires, les artéfacts, les cycles ayant un niveau de bruit très élevé, et d'aligner chaque QRS pour commencer le moyennage. Pour y parvenir, on compare chaque QRS avec un gabarit pré-sélectionné soit par l'utilisateur de l'appareil, soit par l'ordinateur.
Une fois que l'ordinateur a détecté et aligné un complexe, la deuxième étape commence avec la 'sommation', point par point, pour chaque dérivation ; ensuite, la somme est divisée par le nombre de cycles détectés. Le niveau de bruit est ainsi réduit après le moyennage, à cause de sa nature aléatoire. Théoriquement, le bruit est réduit proportionnellement à la racine carrée du nombre de battements cardiaques moyennés. La source la plus importante du bruit est constituée par les muscles de la paroi thoracique.
La plupart des études ont fixé arbitrairement le nombre des cycles 'moyennés' à 200-300 cycles ; cela ne tient pas compte de la grande variabilité du bruit d'un sujet à l'autre. De ce fait, l'approche actuellement utilisée est de mesurer le bruit pendant tout le processus, jusqu'à ce que soit atteint un niveau du bruit prédéterminé. Il arrive cependant que les potentiels de la fin du QRS soient encore masqués par le QRS lui-même. Il faut donc passer le complexe à travers un 'filtre' dans le but d'atténuer tous les signaux se trouvant en-dessous et au-dessus de certaines fréquences. Les signaux déjà amplifiés et filtrés sont combinés par un vecteur qui est la racine carrée de la somme :
x2 + y2+ z2
Une estimation quantitative des trois paramètres suivants est donnée par l'ordinateur pour déterminer si des potentiels tardifs sont présents ou non :
-
QRS filtré : la durée du QRS 'moyenné'. En présence de potentiels tardifs, ce paramètre sera prolongé par rapport au QRS non filtré.
-
LAS 40 mV : la durée de l'activité terminale de QRS inférieur à 40 mV.
-
RMS 40 ms ('root mean square' de 40 ms) : amplitude des 40 dernières millisecondes du QRS 'moyenné'
Lorsque deux au moins de ces trois paramètres sont anormaux, on dit que des potentiels tardifs sont présents.
1.1.2 Valeurs normales de l'ECG HA chez l'adulte et chez l'enfant
Des normes ont été proposées chez l'adulte (9) mais elles sont probablement inapplicables chez l'enfant. Peu de séries ont été réalisées pour établir des normes chez l'enfant (12, 13, 14).
Il est démontré que les valeurs normales sont variables en fonction de l'âge. Le QRSf et le LAS 40 augmentent avec l'âge, alors que le RMS 40 diminue avec l'âge. Ces variations sont plus évidentes pour les enfants les plus jeunes et deviennent minimes après l'âge de 10 ans (13).
| Tabl. 1 : Moyennes et déviations standards pour les paramètres de l'ECG HA dans les différents groupes d'âge (13) |
| Groupe d'âge |
QRSf (ms) |
LAS 40 (ms) |
RMS 40 (mV) |
| 0-12 mois |
88,9±7,87 |
17,0±3,44 |
122,4±33,30 |
| 1-5 ans |
97,8±8,1 |
20,6±7,36 |
89,0±40,76 |
| 6-10 ans |
105,1±5,84 |
24,2±5,97 |
61,3±28,78 |
| 11-16 ans |
108,7±8,51 |
24,5±5,64 |
60,9±31,27 |
1.1.3 Application clinique de l'ECG HA à haute amplification
Cette technique non invasive détecte la présence de potentiels tardifs associés à un haut risque de tachycardie ventriculaire. Cette association est particulièrement bien démontrée dans les suites d'un infarctus du myocarde, dans les cardiomyopathies dilatatives et dans les dysplasies arythmogènes du ventricule droit. On utilise cette association pour établir le diagnostic étiologique des syncopes ou plus généralement pour démontrer la présence d'un substrat arythmogène dans diverses maladies du coeur.
1.1.3.1 Stratification du risque après l'infarctus du myocarde
Les potentiels tardifs révélés par l'ECG HA reflètent des petites zones de myocarde altéré où la conduction est ralentie. Ces zones se situent autour des cicatrices d'infarctus du myocarde. Elles seraient le substrat arythmogène des réentrées ventriculaires (10). Plusieurs études ont montré que la présence de potentiels tardifs après un infarctus du myocarde constituait un marqueur pronostique pour la survenue d'un trouble du rythme ventriculaire grave. En 1980, SIMSON évalue l'ECG HA de surface comme un moyen possible d'identifier certains patients à risque élevé de tachycardie ventriculaire après infarctus du myocarde (15, 16). Ses résultats montrent que les potentiels tardifs chez ces patients sont corrélés avec des tachycardies ventriculaires déclenchées (par stimulation ventriculaire) et des tachycardies ventriculaires spontanées. L'électro-cardiogramme à haute amplification a une faible spécificité, raison pour laquelle plusieurs chercheurs ont proposé son utilisation en combinaison avec d'autres examens non invasifs (la fraction d'éjection gauche, mesurée par l'echo cardiaque, les données de l'enregistrement Holter), dans le but de mieux définir les patients à risque élevé (11). D'autres ont adopté une stratégie consistant en deux étapes :
Première étape : application systématique d'une série de tests non invasifs (Holter, mesure de la fraction d'éjection du ventricule gauche, ECG HA) à tous les patients après leur sortie de l'hôpital.
Deuxième étape : les patients à haut risque, définis par la présence d'au moins 2 tests non invasifs positifs, subissent une stimulation ventriculaire programmée (17). Sachant que la stimulation ventriculaire programmée n'est pas universellement disponible, qu'elle est chère et qu'elle a un risque potentiel quoique minime, cette stratégie semble logique.
1.1.3.2. L'électro-cardiogramme à haute amplification dans les cardiomyopathies
Les cardiomyopathies sont des affections à haut risque de mort subite. Elles sont également parfois associées à des arythmies ventriculaires complexes.
La pathologie de ces cardiomyopathies est principalement caractérisée par des myofibrilles désorganisées et une fibrose intersticielle qui peuvent être à l'origine des anomalies de conduction dans le système de conduction lui-même (relevées par l'ECG de surface) ou une fragmentation et une désorganisation des forces de propagation électromotrice (relevée par l'ECG HA). Cette pathologie peut expliquer la prédisposition aux événements arythmiques chez ces sujets (11). L'électro-cardiogramme à haute amplification a été proposé comme examen non invasif, dans le but d'évaluer le risque de développement d'une arythmie ventriculaire chez un sujet atteint de cardiomyopathie dilatative ou hypertrophiante.
Les différentes études montrent que l'ECG HA a une excellente sensibilité pour évaluer le risque de tachycardie ventriculaire soutenue inductible ; de même, il donne des indications sur le risque de tachycardie soutenue spontanée (18). Cette corrélation est moins évidente dans les cardiomyopathies hypertrophiantes que dans les cardiomyopathies dilatatives (19).
Par contre, la détection du risque de mort subite est mal démontrée et l'indication du traitement anti-arythmique dans ce cas est actuellement particulièrement discutée.
1.1.3.3. Application clinique chez les patients avec syncope inexpliquée (20)
Plusieurs auteurs ont suggéré l'utilisation de l'ECG HA chez les patients ayant fait un épisode de syncope inexpliquée. Ils ont montré une bonne corrélation entre l'ECG HA et l'induction d'une tachycardie ventriculaire durant l'étude électrophysiologique chez ces patients.
Bien que le rôle essentiel de l'ECG HA comme prédicteur de tachycardie ventriculaire inductible ait été bien établi, d'autres études seront indispensables pour juger son utilité dans la prédiction des tachycardies ventriculaires spontanées et du risque de mort subite chez ces patients.
1.1.3.4. Application de l'ECG HA dans la dysplasie ventriculaire droite (21)
L'intérêt de la mise en évidence des potentiels tardifs dans la forme classique de la dysplasie du ventricule droit arythmogène a été signalée dans la littérature. On a comparé des sujets témoins avec des patients porteurs de cette maladie avec tachycardie ventriculaire soutenue ; on a montré une différence nette entre ces deux groupes pour les trois valeurs de l'ECG HA, à savoir le QRSf, le RMS 40 et le LAS 40. L'ECG HA est d'autant plus pathologique que l'atteinte angiographique est plus évidente et que le patient est plus âgé. On a pu en conclure que l'ECG à haute amplification est d'un apport précieux dans le diagnostic de la dysplasie ventriculaire droite, en présence de tachycardie ventriculaire soutenue.
1.1.3.5. Rôle des potentiels tardifs dans l'identification des patients à risque de tachycardie ventriculaire après correction de tétralogie de Fallot
On trouve chez les patients ayant bénéficié d'une correction complète de tétralogie de Fallot (ventriculotomie, résection infundibulaire et fermeture de communication inter-ventriculaire) du tissu fibreux anormal en différents sites du ventricule droit, spécialement chez les patients ayant eu une correction tardive (au-delà de l'âge de 5-8 ans). Ce tissu fibreux est à l'origine d'anomalies électrophysiologiques sous forme de potentiels électriques fractionnées et retardées, substrat pour des réentrées (4, 7, 22). L'ECG HA enregistre de façon non invasive ces anomalies. Si cette méthode permet la prédiction du risque d'arythmie sévère après un infarctus aigu et les cardiomyopathies, sa valeur dans la période post-opératoire de tétralogie de Fallot n'est pas claire.
ZIMMERMANN a montré le premier que les potentiels tardifs étaient présents chez 24% des opérés, il n'a pas trouvé de relation, dans la période post-opératoire immédiate, entre les anomalies de la dépolarisation ventriculaire et la survenue d'arythmies ventriculaires spontanées trouvés au Holter (22,23). En 1990, ZIMMERMANN a montré que la présence de potentiels tardifs chez ces patients était associée à une tachycardie déclenchable pendant une étude électrophysiologique, ce qui suggère que les deux tests interrogent le substrat des réentrées dans les arythmies ventriculaires (6). En 1995, JANUSEK a suggéré que l'ECG HA était intéressant dans la stratification du risque de tachycardie ventriculaire chez les patients ayant eu une ventriculotomie lors de la correction d'une cardiopathie congénitale (24). En association avec d'autres facteurs en particulier la lourdeur de l'intervention, les potentiels tardifs ont permis d'identifier les patients à faible et à haut risque de tachycardie ventriculaire soutenue (24).
Il faut se souvenir que les tachycardies ventriculaires surviennent chez les opérés de tétralogie de Fallot à l'âge adulte, de nombreuses années après l'intervention. Seul un suivi très prolongé pourra ainsi établir la valeur pronostique de l'ECG HA.
1.1.4 Comment interpréter une électrocardiogramme à haute amplification en présence de bloc de branche complet
Cette question est importante dans la mesure où 80 à 90% des patients opérés présentent un bloc de branche droit.
Il est hasardeux de vouloir interpréter un électro-cardiogramme à haute amplification en cas de bloc de branche droit complet, la spécificité des différents critères devient faible. La plupart des études concernant l'infarctus et la cardiomyopathie dilatée primitive ont exclu les patients présentant un bloc de branche (15, 16, 18).
Jusqu'à aujourd'hui, on trouve peu d'études, dans la littérature, sur les résultats de l'analyse temporelle classique de l'ECG HA en cas de troubles de conduction et de bloc de branche. On sait que les troubles de la conduction fragmentent et retardent le signal électrique ; on s'attend ainsi à ce que le bloc de branche change le signal de l'ECG HA et il est probable qu'il masque les potentiels tardifs(6, 22).
Les différentes études montrent que l'existence d'un bloc de branche complet provoque des anomalies de l'ECG HA : il apparaît un élargissement du QRS filtré et une baisse des voltages terminaux avec une diminution du RMS 40 et une augmentation du LAS 40 (7). Les critères auxquels ces études ont abouti sont quelque peu différents (voir tableau 2) :
Buckingham et son équipe ont adopté les critères suivants pour identifier les patients à risque
-
élargissement du QRSf au-delà de 145 ms
-
RMS 40 £17 µ
-
LAS 40 ³45 ms
Vu le nombre limité de patients, les critères ont été analysés indépendamment du type de bloc de branche droit ou gauche. L'ensemble de ces critères a une valeur diagnostique médiocre, et une sensibilité et une spécificité de 60 % (25).
Brembilla et son équipe ont étudié séparément l'influence du bloc de branche gauche et droit sur les critères de l'ECG HA et en fonction de la cardiopathie sous-jacente. Ils ont trouvé qu'une valeur de QRSf à 160 ms et un RMS 40 inférieur à 20 mV pour le bloc de branche droit associé aux séquelles d'un infarctus, était assez fiable pour différencier les sujets avec ou sans tachycardie ventriculaire (26).
Gatzoulis et son équipe ont étudié les critères de l'ECG HA chez les patients avec des troubles de la conduction de type bloc de branche droit, bloc de branche gauche et troubles de la conduction non spécifiques, en distinguant deux groupes : un premier groupe avec des troubles de la conduction mineurs, définis par un QRS situé entre 100 ms et 120 ms sur l'ECG standard ; un deuxième groupe avec des troubles de la conduction majeurs, avec un QRS ³120 ms sur l'ECG standard. D'après les résultats, les critères conventionnels restent acceptés pour le premier groupe, mais on préconise certaines modifications dans les critères pour le deuxième groupe, à savoir :
-
QRS f ³145 ms
-
RMS 40 £17,5 mv
-
LAS 40 ³50 ms
La combinaison entre deux critères améliore l'identification des sujets à risque qui ont présenté une tachycardie ventriculaire inductible, avec une sensitivité de 68 % et une spécificité de 73 % (27).
| Tabl. 2 : Valeur diagnostique des différents paramètres de l'électro-cardiogramme haute amplification chez des patient avec troubles de la conduction selon différentes études . |
| Etude |
|
Durée du QRSf(ms) |
LAS 40(ms) |
RMS 40(mv) |
| |
nb de patients |
Mesure / sensibilité / spécificité |
Mesure / sensibilité / spécificité |
Mesure / sensibilité / spécificité |
| Buckingham et coll. |
79 |
³145 |
67 % |
60 % |
³45 |
62 % |
62 % |
£17 |
52 % |
57 % |
| Brembilla et coll. |
56 |
³160 |
60 % |
71 % |
³30 |
83 % |
64 % |
£20 |
73 % |
50 % |
| Gatzoulis et coll. |
70 |
³145 |
69 % |
69 % |
³50 |
65 % |
65 % |
£17,5 |
68 % |
68 % |
1.2 La dispersion de l'espace QT
L'intervalle QT mesure le temps de dépolarisation et de repolarisation du myocarde. Cet intervalle varie normalement légèrement d'une dérivation à l'autre sur l'ECG de surface créant ce qu'on appelle 'la dispersion du QT'. L'augmentation de la dispersion du QT, plus que l'allongement du QT, semble être un marqueur d'identification des sujets à risque de troubles de rythme ventriculaire.
La dispersion de l'intervalle est donc un reflet électro-cardiographique de surface d'une inhomogénicité du processus de récupération dans le myocarde, autrement dire, c'est un reflet de la dispersion de la période réfractaire du myocade. Ceci est un facteur prédisposant aux troubles de rythme par réentrées (28). S'il est vrai que ce concept a été mis en doute (29,30), cette mesure garde tout de même sa valeur comme marqueur d'arythmie.
1.2.1 Valeurs normales chez l'enfant (13)
Il a été démontré que le dQT, contrairement aux paramètres ECG HA, ne varie pas avec l'âge. Dans notre laboratoire, nous avons démontré, sur 111 enfants normaux, que la moyenne du dQT est de 36,3 +/- 13,7 ms. Sachant que le 95ème percentile se trouve à 63 ms, toute valeur au-dessus est considérée comme pathologique, indépendamment de l'âge.
1.2.2 Application clinique de la mesure de la dispersion du QT
Diverses études se sont penchées sur le lien présent entre la dispersion de l'intervalle QT et la présence des arythmies ventriculaires chez les sujets sains et dans les diverses cardiopathies à risque de tachycardies ventriculaires. Ces études incluaient les pathologies suivantes :
1. L'infarctus du myocarde et l'ischémie coronarienne
L'augmentation de la dispersion du QT reflète la variation du temps de repolarisation entre le myocarde sain, le myocarde situé dans le péri-infarctus et la zone ischémique ; c'est un marqueur de la dispersion régionale de la repolarisation ce qui est susceptible d'aboutir à un mécanisme de réentrée (31).
Plusieurs études ont montré l'augmentation significative de la dispersion du QT chez les patients ayant développé des arythmies ventriculaires sérieuses post-infarctus, en comparaison de ceux qui ne présentent pas d'arythmies ventriculaires (20, 32, 33, 34).
Certaines études ont même suggéré que ce marqueur peut être prédictif d'une mortalité subséquente (35).
Dans l'insuffisance cardiaque chronique secondaire à une ischémie cardiaque, l'utilisation de cette méthode simple et reproductible peut identifier les sujets à risque élevé de mort subite.
D'autres études ont utilisé la dispersion du QT en association avec d'autres méthodes non invasives : les potentiels tardifs, la variabilité du rythme cardiaque et la fraction d'éjection, pour mieux identifier les sujets à risque élevé de tachycardies ventriculaires (28, 32).
2. Les cardiomyopathies
Le substrat pathologique dans les cardiomyopathies peut être à l'origine d'un long intervalle du QT et d'une inhomogénicité du processus de récupération.
Plusieurs études ont démontré que la dispersion du QT aide à distinguer entre les patients avec et les patients sans tachycardies ventriculaires dans les cardiomyopathies hypertrophiantes et dans les cardiomyopathies dilatatives primitives (28, 32, 36). Le rôle de la mesure de la dispersion du QT paraît plus intéressant si on l'utilise en combinaison avec l'ECG à haute amplification, en vue d'une meilleure détection des patients à risque.
L'intérêt de cette mesure a été également démontrée dans la stratification des patients inscrits sur une liste d'attente de transplantation cardiaque, ce qui peut aider à établir une priorité dans cette liste (37).
3. Le syndrome du QT long idiopathique
Le lien entre la dispersion du QT augmenté et la présence de troubles du rythme ventriculaire est bien démontré chez les patients atteints du syndrome du QT long idiopathique. La dispersion du QT et de sa composante JT sont plus allongées chez les sujets présentant des arythmies ventriculaires critiques (38).
4. La tétralogie de Fallot
La correction complète d'une tétralogie de Fallot n'est pas dénuée de certaines complications à long terme. Le matériel utilisé pour l'opération (patch d'élargissement de la voie de chasse droite, patch pour fermer la communication inter-ventriculaire), l'incision infundibulaire et sa cicatrice, la surcharge hémodynamique à cause des lésions résiduelles et finalement les troubles de conduction par interruption de la branche droite du faisceau de His ou l'atteinte distale du système de Purkinje ; tous ces facteurs peuvent causer une dépolarisation et une repolarisation hétérogène. Chez les patients opérés tardivement surtout, il existe, même avant l'intervention, un remaniement fibreux de certaines parties du ventricule droit, surtout de l'infundibulum.
Cette inhomogénicité, comme on a déjà signalé, peut aboutir à des arythmies ventriculaires par réentrée (39).
Les études réalisées récemment notent une augmentation significative de la dispersion du QT chez les sujets opérés, cette augmentation est maximale dans les groupes présentant des arythmies ventriculaires sévères post-opératoires (7, 40).
La combinaison de la dispersion allongée du QT, du JT, du QRS, et un QRS ³180 ms, raffine la stratification du risque de tachycardie ventriculaire chez ces patients (40).
Cependant, vu le petit nombre des patients étudiés, la relation entre la dispersion du QT augmentée et de ses composantes d'une part et le risque de mort subite d'autre part reste mal démontré (41).
1.3 But de l'étude
Un grand nombre d'études a déjà largement traité du rôle des potentiels tardifs et de la dispersion de l'espace QT chez les adultes, en particulier dans les maladies prédisposant aux tachycardies ventriculaires, telles que l'infarctus du myocarde, l'ischémie coronarienne, l'insuffisance cardiaque congestive, les cardiomyopathies, le syndrome du QT long et la dysplasie du ventricule droit.
Chez l'enfant et l'adolescent, la tachycardie ventriculaire est beaucoup plus rare que chez l'adulte. Un risque non négligeable de tels troubles du rythme existe cependant dans diverses atteintes cardiaques, en particulier après une chirurgie à coeur ouvert chez les patients atteints de tétralogie de Fallot. Si la tachycardie ventriculaire est rare chez l'enfant, le risque de mort subite existe néanmoins. L'étude des potentiels tardifs et de la dispersion augmentée du QT, et plus récemment du JT nous paraît donc d'un grand intérêt dans cette pathologie.
Quelle est la prévalence des potentiels tardifs et de la dispersion augmentée de l'espace QT ?
Quelles sont les variations de l'espace QT, de l'espace JT et des paramètres de l'ECG HA chez les enfants atteints de tétralogie de Fallot, avant et après la correction complète ?
Comment évoluent ces variations avec un suivi longitudinal dans la période post-opératoire ?
Voici les interrogations sur lesquelles nous nous sommes penchés.
2. Patients et méthodes
2.1 Patients
De novembre 1995 à août 1998, nous avons étudié prospectivement les tracés ECG standards et les ECG à haute amplification de 59 patients non sélectionnés. Quarante-sept patients étaient porteurs de tétralogie de Fallot, soit 80 % des patients, 7 de pentalogie de Fallot (12 %), 5 de ventricule droit à double issue de type Fallot (8 %). Il y avait 30 filles (51 %) et 29 garçons (49 %), âgés de 10 mois à 24 ans (moyenne 6,54 +/- 4,83 ans). Cinquante-six patients ont bénéficié d'une correction complète chirurgicale (95 %), 2 patients ont bénéficié d'une palliation selon Brock modifié, cette opération a été suivie par une correction complète chez un patient. Un Blalock a été réalisé chez un patient, la correction complète étant prévue ultérieurement. Chez un enfant porteur de tétralogie de Fallot extrême, l'abstention chirurgicale a été décidée. Il y a eu un décès en post-opératoire immédiat, en raison d'un choc cardiogène. L'âge des enfants au moment de l'opération varie de 5 mois à 15,75 ans (moyenne 4,90 +/- 3,80 ans).
Au total 56 patients ont été opérés par correction complète, 14 (soit 25 %) ont du être soumis à une reprise chirurgicale, en moyenne 3,24 ans après la première opération. Sur les 14, un seul patient a bénéficié de deux reprises chirurgicales et un autre patient a nécessité trois reprises chirurgicales (voir tableau 3). Le pourcentage de réintervention ne reflète pas le taux habituel de reprise après une correction complète de notre centre, parce que notre collectif de patients comprend des enfants opérés avant le début de l'étude.
2.2 Groupes de classification (cf. tableaux 4-11)
Nous avons réalisé 120 tracés d'ECG de surface et d'ECG à haute amplification chez les 59 patients étudiés.
Ces tracés ont été classés en 7 groupes différents :
-
groupe 1 : tracés réalisés avant la correction complète, soit 38 tracés.
-
groupe 2 : tracés réalisés après la correction complète, dans l'intervalle moyen de 9 (+/- 3) jours, soit 22 tracés.
-
groupe 3 : tracés réalisés après la correction complète, dans l'intervalle moyen de 35 (+/- 16) jours, soit 33 tracés.
-
groupe 4 : tracés réalisés tardivement après la correction complète, dans l'intervalle de 9 mois à 17 ans, (moyenne 6 ans), soit 15 tracés.
-
groupe 5 : tracés réalisés après la reprise chirurgicale, dans l'intervalle de 3 mois à 17 ans (moyenne 5 ans), soit 12 tracés.
-
groupe 6 : tracés réalisés après la correction complète (groupes 2, 3, 4 et 5), au total 82 tracés.
-
groupe 7 : tracés présentant des critères de positivité pour les potentiels tardifs, soit 9 tracés.
Ensuite, nous avons extrait des trois premiers groupes 20 patients chez lesquels nous disposions de 3 tracés par patient :
-
un tracé avant l'opération (= pré-op.)
-
un tracé réalisé dans les 9 jours (+/- 3 jours) après l'opération (= post-op.1)
-
un tracé réalisé dans les 35 jours (+/- 11 jours) après l'opération (= post-op. 2)
Ce groupe sera dénommé dans l'étude : 'groupe suivi'.
2.3 Mesure de la dispersion de l'espace QT et de l'espace JT
Les mesures ont été effectuées sur des électro-cardiogrammes standard à 12 dérivations, à une vitesse de papier de 25 mm/s, en utilisant un appareil MARQUETTE.
L'espace QT a été mesuré manuellement dans les 6 dérivations standards et les 6 précordiales de V1 à V6, depuis le début du complexe QRS jusqu'à la fin de l'onde T, définie par son retour à la ligne de base isoélectrique.
L'espace JT a été mesuré manuellement dans les mêmes dérivations, depuis la fin du complexe QRS jusqu'à la fin de l'onde T.
Trois mesures sont faites sur 3 complexes consécutifs dans chaque dérivation, pour en faire la moyenne, sauf dans celles où la fin de l'onde T est difficilement visualisable (onde T isoélectrique). La différence entre la valeur maximale et la valeur minimale de l'intervalle QT,JT définit respectivement la dispersion de l'espace QT et la dispersion de l'espace JT.
Nous avons étudié 120 tracés. Deux examinateurs ont effectué chacune des mesures réalisées, nous avons retenu la moyenne des mesures des deux examinateurs. Un troisième examinateur a participé à une partie des mesures réalisées en cas de divergence de mesure supérieure à 20 ms ; dans ce cas, les deux valeurs les plus proches ont été retenues pour faire la moyenne. Toute valeur de dQT supérieure à 63 ms a été considérée comme pathologique (13). En ce qui concerne la valeur pathologique de l'espace JT, nous ne disposons pas d'étude publiée.
Nous n'avons pas fait de correction pour la fréquence cardiaque, (dQTc et dJTc) car une telle correction introduit une erreur en augmentant faussement la dispersion (13).
2.4 Potentiels tardifs ventriculaires
Nous avons effectué les enregistrements avec un appareil MARQUETTE Mac 15, avec filtre bidirectionnel (40-250 Hz). Des électrodes en chlorure d'argent ont été disposées selon les 3 dérivations bipolaires orthogonales de Frank (X, Y et Z) :
-
l'axe X entre V6 à droite et V6
-
l'axe Y entre la base du cou (H) et le membre inférieur gauche
-
l'axe Z entre la xyphoïde (E) et le point paravertébral gauche à la hauteur de V4.
L'enfant était couché en décubitus dorsal. Les électrodes étaient disposées après avoir soigneusement nettoyé la peau avec un mélange d'alcool et d'éther.
Pour chaque enregistrement, nous avons effectué la somme et la moyenne de 81 à 1001 complexes, dans le but de réduire le bruit de fond à 0,3 mv. Ceci n'est pas toujours possible, le bruit moyen étant de 0,5 +/- 0,18 mv. Les tracés avec un bruit de fond de plus de 1 mv ont été exclus.
Nous avons analysé les trois paramètres suivants :
-
la durée du QRS filtré (QRSf)
-
la durée des signaux terminaux de basse amplitude, inférieurs à 40 mv (LAS 40)
-
le voltage moyen des 40 dernières millisecondes du QRS : root mean square (RMS 40).
Des potentiels tardifs dans les tracés pré-opératoires sont considérés comme présents et positifs si au moins deux de ces paramètres diffèrent de la norme définie au préalable dans notre centre (13).
Etant donné que les tracés post-opératoires comportent des blocs de branche droits complets, nous avons adopté les critères établis par Buckingham et coll., en présence de bloc de branche :
-
QRSf ³145 ms
-
LAS 40 ³45 ms
-
RMS 40 £17 mv
Pour définir la présence de potentiels tardifs positifs en présence de bloc de branche droit complet, il est nécessaire qu'au moins 2 critères soient positifs (25). Chaque analyse d'ECG à haute amplification est accompagnée d'un calcul de la dispersion du QT et d'un calcul de la dispersion du JT, faits sur un ECG standard réalisé simultanément.
2.5 Analyses statistiques
Pour chaque paramètre analysé dans chaque groupe de tracé, nous avons calculé la moyenne et la déviation standard, et nous avons ensuite comparé les moyennes entre les enfants malades et les enfants normaux, à l'aide du ' test t de Student '.
Les moyennes des paramètres analysés dans les groupes 1, 2, 3, 4 et le 'groupe suivi' (voir sous II) ont été comparées, selon la méthode ANOVA 'one way analyses of variance'. Dans les cas où la différence s'avérait significative, nous avons effectué le 'Bonferroni's multiple comparaison test'.
La différence de prévalence des potentiels tardifs entre les patients opérés par correction complète et les enfants avec reprise chirurgicale a été évaluée à l'aide du 'Fischers test'.
3. Résultats
Nous avons analysé 120 tracés d'ECG standards et 120 tracés d'ECG à haute amplification.
3.1 Dispersion de l'espace QT (dQT), Dispertion de l'espace JT (dJT)
Nous avons calculé la moyenne de la dispersion de l'espace QT et de la dispersion de l'espace JT dans chaque groupe.
La moyenne de la dispersion de l'espace QT a été établie chez 111 enfants normaux, soit 36,3 +/- 13,71 ms (13). Nous avons comparé cette moyenne à la moyenne obtenue dans chaque groupe.
Groupe 1 (non opérés) (cf. tableaux 4,12a et figure1)
Sur 38 patients, nous constatons que 14 d'entre eux (37 %) présentent une dispersion du QT supérieure à 63 ms. La moyenne de dispersion de l'espace QT est de 60,08 +/- 25,375 ms et celle de l'espace JT de 53,63 +/- 27,458 ms.
Ainsi, la dQT est significativement plus élevée avant l'opération que chez les enfants normaux : p=1,98 E-11.
Groupe 2 (post-op précoce) (cf. tableaux 5,12a et figure1)
Sur 22 patients, nous constatons que 10 d'entre eux (45%) présentent une dispersion du QT supérieure à 63 ms. La moyenne de dispersion de l'espace QT est de 67,45 +/- 28,658 ms et celle de l'espace JT de 58,68 +/- 24,755 ms, chez les patients étudiés dans un délai de 9 jours après l'opération. Ainsi, la dQT est significativement plus élevée dans ce groupe de patients que chez les enfants normaux : p=1,35 E-12.
Groupe 3 (+/-35 jours après l'opération) (cf. tableaux 6,12a et figure1)
Sur les 33 enfants du groupe, nous constatons que 25 d'entre eux présentent une dispersion du QT supérieure à 63 ms (76 %). La moyenne de dispersion du QT est de 88,30 +/- 39,971 ms et celle de l'espace JT de 74,33 +/- 38,156 ms chez les patients étudiés dans le délai moyen de 35 jours après l'opération. Ainsi, la dQT est significativement plus élevée dans ce groupe de patients que chez les enfants normaux : p= 1,83 E-22.
Groupe 4 (post-op tardif) (cf. tableaux 7,12a et figure1)
Sur les 15 patients de ce groupe, nous constatons que 10 ( 67 %) d'entre eux présentent une dispersion du QT supérieure à 63 ms. La moyenne de dispersion du QT est de 79,33 +/- 33,640 ms et celle de l'espace JT de 66,47 +/- 28,173 ms chez les patients étudiés tardivement après l'opération. Ainsi, la dQT est significativement plus élevée dans ce groupe que chez les enfants normaux : p=1,75 E-15.
Groupe 5 (après la reprise chirurgicale) (cf. tableaux 8,12a et figure1)
Sur les 12 patients de ce groupe, nous constatons que 7 (58 %) d'entre eux présentent une dispersion du QT supérieure à 63 ms. La moyenne de dispersion du QT est de 78,96 +/- 39,391 ms et celle de l'espace JT de 70,67 +/- 38,512 ms chez les patients étudiés après la reprise chirurgicale. Ainsi, la dQT est significativement plus élevée dans ce groupe que chez les enfants normaux : p=1,13 E-12.
Groupe 6 (tous les tracés post-op groupés) (cf. tableaux 9,12a et figure1)
Sur 82 tracés d'ECG effectués après correction complète, nous constatons que 52 (63 %) ont une dispersion du QT supérieure à 63 ms. La moyenne de dispersion du QT est de 79,7 +/- 36,351 ms et celle de l'espace JT de 68,16 +/- 33,377 ms. Ainsi, la dQT est significativement plus élevée chez ces patients que chez les enfants normaux : p=1,14 E-23
Groupe 7 (patients présentant des potentiels tardifs positifs) (cf. tableaux 10,12a et figure1)
Sur 9 patients, nous constatons que 8 (89 %) présentent une dispersion du QT supérieure à 63 ms. La moyenne de dispersion du QT est de 104,17 +/-39,011 ms et celle de l'espace JT de 88,67 +/- 38,630 ms chez nos patients présentant des potentiels tardifs positifs. Ainsi la dQT est significativement plus élevée chez ces patients que chez les enfants normaux : p=1,53 E-21.
En résumé, la dQT est significativement plus élevée dans chacun de nos groupes, par rapport aux enfants normaux. Si nous comparons les tracés avant l'intervention avec la totalité des tracés après l'opération (groupe 1 vs groupe 6), nous constatons que la dQT et la dJT sont significativement plus élevées dans le groupe 6 : respectivement p=0,003, p=0,02. Si nous comparons les patients avant opération avec ceux qui présentent des potentiels tardifs positifs (groupe 1 vs groupe 7), nous constatons que la moyenne de la dQT et celle de la dJT sont significativement plus élevées dans le groupe 7 : respectivement p=0,0001 et p=0,003.
Si nous comparons parmi les patients opérés, ceux qui ont des potentiels tardifs positifs ( =groupe 7 )avec ceux qui sont négatifs, nous constatons que la moyenne de la dQT et celle de la dJT sont significativement plus élevées dans le groupe 7 : respectivement p=0,03 et p=0,05(cf. tableau 12b).
Nous avons également effectué une analyse de variance sur les groupes 1, 2, 3 et 4. Ceci nous a permis de comparer la moyenne de dQT et de dJT dans ces groupes : respectivement p=0,0031 et p=0,039(cf. tableau 13). Ainsi la valeur de dQT et de dJT dans le groupe 1 n'est pas significativement différente de celle du groupe 2, de même pour les valeurs de dQT et dJT dans le groupe 1 versus groupe 4, groupe 2 versus groupe 3, groupe 2 versus groupe 4 et groupe 3 versus groupe 4: p>0,05 pour dQT et dJT dans chaque cas.
La seule différence significative constatée entre ces groupes se situe entre les groupes 1 et 3, à savoir que la valeur de dQT et dJT est significativement plus élevée chez les patients opérés de 35 jours que chez les patients avant l'opération: respectivement p<0,01 et p<0,05.
Sous groupe 'suivi' longitudinalement (patients évalués avant et deux fois après l'opération) :( cf. tableaux 11,14 et figures 2,3)
-
Sur 20 tracés réalisés dans la période pré-opératoire, nous constatons que 8 (40 %) d'entre eux ont une dQT supérieure à 63 ms. La moyenne de dispersion du QT est de 59,05 +/- 27,723 ms et celle de la dJT de 54 +/- 30,147 ms. Ainsi la valeur de dQT est significativement plus élevée chez les malades que chez les enfants normaux : p=9,31 E-08.
-
Sur 20 tracés réalisés dans la période post-opératoire 1 (délai moyen de 9 jours), nous constatons que 9 (45 %) d'entre eux ont une dQT supérieur à 63 ms. La moyenne de dispersion du QT est de 66,70 +/- 29,622 ms et celle du JT de 57,05 +/- 24,097 ms. Ainsi la valeur de dQT est significativement plus élevée chez les malades que chez les enfants normaux : p=1,99 E-11.
-
Sur 20 tracés réalisés dans la période post-opératoire 2 (délai moyen 35 jours), nous constatons que 18 (90 %) d'entre eux ont une dispersion du QT supérieure à 63 ms. La moyenne de dispersion du QT est de 95,75 +/- 34,038 ms et celle du JT de 84,75 +/- 34,498 ms. Ainsi la valeur de dQT est significativement plus élevée chez les enfants malades que chez les enfants normaux : p=2,56 E-26.
Nous avons également fait une analyse de variance, en prenant les tracés de ces 20 patients avant l'opération, puis dans les 9 jours après opération (post-op.1), puis dans les 35 jours après opération (post-op.2). Ceci nous a permis de comparer les résultats obtenus dans ces trois périodes, qui diffèrent significativement ; p=0,0004 pour la dQT et p=0,0027 pour la dJT(cf. tableau 15).
Ainsi la valeur de dQT et de dJT dans la période pré-opératoire n'est pas significativement différente de celle de la période post-opératoire 1 : p>0,05. Ce n'est que plus tard, dans la période post-opératoire 2, que cette différence devient significative. Autrement dit, la valeur de dQT et de dJT dans la période post-opératoire 2 est significativement plus élevée que celle de la période pré-opératoire: respectivement p<0,001, p<0,01. De même, la valeur de dQT et de dJT dans la période post-opératoire 2 est significativement plus élevée que celle de la période post-opératoire 1 : respectivement p<0,01 et p<0,05.
3.2 Potentiels tardifs ventriculaires
3.2.1 Prévalence des potentiels tardifs
Aucun patient ne présentait de potentiels tardifs positifs avant l'intervention.
Sur 53 patients opérés par correction complète et pour lesquels nous disposons d'au moins un tracé après l'opération, nous trouvons 9 patients avec potentiels tardifs ventriculaires positifs (17 %) - (groupe 7). Sur les 9, 3 sont des filles, 6 sont des garçons. Sur ces 9 patients, 4 ont eu une deuxième opération.
En prenant chaque groupe séparément, nous constatons
-
qu'aucun tracé des groupes 1 et 2 ne présente de potentiels tardifs positifs, c'est-à-dire avant l'intervention et dans un délai de 9 jours après l'intervention.
-
que 12 % des tracés (4/33) présentent des potentiels tardifs positifs dans le groupe 3
-
que 7 % des tracés (1/15) présentent des potentiels tardifs positifs dans le groupe 4
-
que 33 % des tracés (4/12) présentent des potentiels tardifs positifs dans le groupe 5.
En prenant chaque paramètre séparément, nous constatons :
-
dans le groupe 1 : 8 % des tracés (3/38) présentent un QRSf allongé ; aucun tracé ne présente de LAS40 allongé, ni de RMS 40 de bas voltage ;
-
dans le groupe 2 : 23 % des tracés (5/22) présentent un QRSf allongé ; 2 tracés présentent un LAS 40 allongé (9 %), aucun tracé ne présente d'anomalie du RMS 40 ;
-
dans le groupe 3 : 24 % des tracés (8/33) présentent un QRSf allongé ; 8 tracés présentent un LAS 40 allongé, soit 24 % ; 2 tracés présentent un RMS 40 de bas voltage, soit 6 % des tracés ;
-
dans le groupe 4 : 67 % des tracés (10/15) présentent un QRSf allongé, 2 présentent un LAS 40 allongé (soit 13 %), aucun tracé ne présente d'anomalie du RMS 40 ;
-
dans le groupe 5 : 75 % des tracés (9/12) présentent un QRSf allongé, 3 tracés (25 %) présentent un LAS 40 allongé, 4 tracés (33 %) présentent un RMS 40 de bas voltage ;
-
dans le groupe 6 : 39 % des tracés (32/82) présentent un QRSf allongé, 15 tracés (18 %) présentent un LAS 40 allongé, 6 tracés présentent un RMS 40 de bas voltage (7 %).
-
dans le groupe 7 (enfants présentant des potentiels tardifs positifs) : 78 % des tracés (7/9) présentent un QRSf allongé, 8 tracés (89 %) présentent un LAS 40 allongé et
-
6 tracés (67 %) présentent un RMS 40 de bas voltage.
La différence de prévalence de potentiels tardifs entre les enfants opérés par correction complète et les enfants réopérés n'est pas significative : p>0,05.
Chez les 20 patients du groupe 'suivi' : des potentiels tardifs sont présents chez 4 patients (20 %), tous détectés dans la période post-opératoire 2 (intervalle moyen de 35 jours par rapport à l'opération). En prenant chaque paramètre séparément, nous constatons que dans la période pré-opératoire, un tracé sur 20 présente un QRSf allongé (5 % des tracés), et qu'aucun ne présente de LAS 40 allongé, ni de RMS 40 de bas voltage. Dans la période post-opératoire 1, 25 % des tracés (5/20) présentent un QRSf allongé, 2tracés présentent un LAS 40 allongé (10 %), et aucun tracé ne présente de RMS40 de bas voltage. Dans la période post-opératoire 2, 30 % des tracés (6/20) présentent un QRSf allongé, 7 tracés présentent un LAS 40 allongé (35 %), et 2 tracés (10 %) présentent un RMS 40 de bas voltage(figure 5).
3.2.2 Moyennes et statistiques
Nous avons calculé la moyenne pour chaque paramètre dans chaque groupe séparément. Nous avons ensuite pris un nombre d'enfants normaux (N) identique à celui de chaque groupe. Le choix des enfants normaux a été fait de telle sorte qu'ils aient le même âge et le même sexe dans les groupes comparés. La moyenne des différents paramètres a été établie chez les enfants normaux. Nous l'avons comparée à la moyenne des différents paramètres obtenue dans chacun de nos groupes de patients. (cf. tableaux 14,16 et figures 4,5,6)
En résumé, le QRSf est significativement plus élevé dans tous les groupes étudiés après l'intervention que dans les groupes des enfants normaux. Ceci s'explique par la présence de bloc de branche droit après l'opération.
Le LAS 40 chez les enfants malades augmente significativement par rapport au LAS 40 chez les enfants normaux dans les groupes 3, 6 et 7. Dans le groupe 'suivi' les valeurs obtenues de LAS 40 ne sont à aucun moment significativement différentes entre les groupes d'enfants normaux et les groupes d'enfants malades.
Enfin, le RMS 40 est significativement moins élevé dans tous les groupes étudiés après l'opération que dans les groupes d'enfants normaux.
Les tableaux 13, 16 et figure 4 montrent l'évolution des paramètres ECG HA pour tous les groupes.
En résumé, le QRSf augmente après l'opération (p<0,001), ce qui est en partie du au bloc de branche droit. Pour le LAS 40, les valeurs moyennes entre les différents groupes ne présentent pas de différence significative. Enfin, pour le RMS 40, on note en moyenne une baisse significative après l'opération (p<0,001), pas de différence significative entre les groupes post-opératoires.
Les tableaux 14, 15 et figures 5, 6 donnent l'évolution des paramètres ECG HA pour les différentes périodes dans le groupe 'suivi'.
En résumé, le QRSf augmente après l'opération (p<0,001). Pour le LAS 40, sa valeur est significativement plus élevée dans la période post-opératoire 2 que dans la période pré-opératoire et dans la période post-opératoire 2 que dans la période post-opératoire 1 (p<0,05). Les valeurs des périodes pré-opératoire et post-opératoire 1 ne sont pas significativement différentes. Enfin, pour le RMS 40, on note en moyenne une baisse significative après l'opération (p<0,001), pas de différence significative entre les deux périodes post-opératoires.
3.2.3 Délai d'apparition des potentiels tardifs
Quel est le temps écoulé entre l'intervention chirurgicale et l'apparition de potentiels tardifs positifs ?
Sur 9 patients porteurs de potentiels tardifs positifs (groupe 7) :
-
3 patients présentaient des potentiels tardifs positifs dès le premier tracé réalisé tardivement après l'opération, donc nous ne disposons pas de tracé permettant de voir la transition de la négativité à la positivité.
-
2 patients sont devenus porteurs de potentiels tardifs positifs après la reprise chirurgicale ; le premier 29 jours après la reprise chirurgicale, soit 17 ans après la correction complète, le deuxième 33 jours après la reprise chirurgicale, soit 7 ans après la correction complète.
Les quatre autres patients appartenant au groupe 'suivi' ont changé de la négativité à la positivité.
Aucun n'avait de potentiels tardifs positifs dans la période pré-opératoire ni post-opératoire 1 , leur apparition était détectée dans la période post-opératoire 2 ; le délai d'apparition est le suivant :
-
patient 1 : 25 jours après la correction complète
-
patient 2 : 22 jours après la correction complète
-
patient 3 : 25 jours après la correction complète
-
patient 4 : 29 jours après la correction complète
4. Discussion
Plusieurs études montrent que la détection des potentiels tardifs d'une part, la dispersion excessive de l'espace QT et JT d'autre part, constituent deux marqueurs pronostiques péjoratifs vis-à-vis de la survenue de troubles du rythme ventriculaires graves, voire de mort subite, bien qu'il existe des divergences selon les études.
Les potentiels tardifs ventriculaires sont des marqueurs du substrat arythmogène, leur présence chez les adultes ayant eu un infarctus du myocarde a été largement étudiée (8, 9, 10, 11, 17). Plusieurs études ont confirmé dans ce type de pathologie, une tendance plus forte à la survenue de troubles du rythme ventriculaires maligne, ou à la mort subite, en cas d'anomalie de l'ECG HA : de 8 à 27 % dans la population des patients avec potentiels tardifs, contre 0,6 à 4 % dans la population sans potentiels tardifs (9). La fréquence de potentiels tardifs ventriculaires chez ces patients est de 24 à 45 % selon les études. Elle varie selon la localisation de l'infarctus : 56 % pour les infarctus inférieurs, contre 27 % pour les infarctus antérieurs (9). Le moment de l'enregistrement joue aussi un rôle dans la variabilité de l'incidence des potentiels tardifs : cette incidence est plus grande dans l'intervalle de 6 à 30 jours après l'infarctus.
Les études des potentiels tardifs chez l'enfant sont peu nombreuses, la plupart porte sur les enfants atteints de cardiomyopathie et les enfants ayant subi une opération à coeur ouvert pour cardiopathie congénitale, en particulier tétralogie de Fallot. Une étude portant sur des enfants atteints de la maladie de Duchenne établit que 22% des patients présentaient des anomalies à l'ECG HA et que les arythmies ventriculaires (stade >/= 2 selon Lown) étaient plus fréquentes chez ces patients que chez les autres (30 % vs 11 %) (42).
Dans une étude de notre centre effectuée sur des enfants atteints de cardiomyopathie d'étiologie variée, on a trouvé une incidence de potentiels tardifs ventriculaires de 20,8 %, sans avoir établi de lien avec un risque élevé d'arythmie ventriculaire (43).
L'étude présente se penche sur la prévalence des potentiels tardifs chez les enfants ayant subi une opération correctrice de tétralogie de Fallot.
Contrairement aux résultats documentés dans le cas de l'infarctus du myocarde, la valeur de l'ECG HA comme prédicteur de la survenue de troubles du rythme ventriculaires après correction de tétralogie de Fallot est un sujet controversé dans la littérature.
Plusieurs auteurs ont étudié la fréquence et l'utilité des potentiels tardifs dans l'identification des patients à risque d'arythmie ventriculaire (6, 7, 22, 23, 24, 44, 45). ZIMMERMANN a trouvé une incidence de 24%, mais il n'a pas trouvé de relation dans la période post-opératoire immédiate entre les anomalies de la dépolarisation ventriculaire et la survenue d'arythmies ventriculaires spontanées, documentées par Holter (6, 22, 23). DALIENTO et coll. ont conclu dans leur étude que l'ECG HA était inutile dans l'identification des patients à risque d'arythmie ventriculaire (7).
Cependant, d'autres auteurs ont souligné la relation existant entre la présence de potentiels tardifs et les tachycardies ventriculaires déclenchables lors d'étude électrophysiologique (6, 24, 44). Globalement, la fréquence de potentiels tardifs ventriculaires varie de 23 à 32 % selon les études.
Dans notre étude, 17 % des enfants opérés présentent des potentiels tardifs ventriculaires. Ce pourcentage est inférieur aux chiffres retrouvés dans la littérature. Ceci peut être expliqué d'une part par l'absence actuelle de consensus sur une définition des potentiels tardifs ventriculaires dans cette situation : Les critères de définition diffèrent selon les auteurs, en fonction de l'existence d'un bloc de branche droit complet, très souvent retrouvé dans la période post-opératoire. D'autre part, la méthode d'enregistrement de l'ECG HA, de même que les filtres, diffèrent selon les études. Autre cause : Inclusion de patients dans la première semaine post-opératoire, où les potentiels tardifs ne sont pas encore constitués.
Cette incidence chez nos patients est encore plus faible que chez ceux atteints d'un infarctus du myocarde ou de cardiomyopathie.
Nos résultats rejoignent ceux des autres études en ce qui concerne l'absence de potentiels tardifs ventriculaires chez les patient avant intervention chirurgicale (22).
L'incidence des potentiels tardifs n'est pas spécialement plus élevée chez les patients ayant bénéficié d'une reprise chirurgicale que chez les autres patients.
Le paramètre RMS 40 est significativement moins élevé chez nos patients après opération que chez les enfants normaux. Cette différence se retrouve aussi entre les patients non opérés et les patients opérés, le RMS 40 étant moins élevé après l'opération.
Le paramètre LAS 40 est significativement plus élevé sur la totalité des tracés analysés chez les patients opérés que sur les tracés des enfants normaux. Cette différence se retrouve aussi entre les tracés avant opération et les tracés après opération, le LAS 40 étant plus élevé après l'opération.
En ce qui concerne le QRSf, étant donné la présence d'un bloc de branche droit complet sur les tracés post-opératoires, on s'attendait à trouver une prolongation significative du QRSf après l'opération, par rapport aux tracés des enfants normaux et par rapport aux mesures pré-opératoires.
Dans l'étude de DALIENTO, le LAS 40 et le RMS 40 chez les enfants opérés pour tétralogie de Fallot sont comparables aux valeurs trouvées chez les enfants normaux porteurs de bloc de branche droit incomplet (7).
Nous avons étudié l'évolution des paramètres de l'ECG HA dans le temps : avant l'opération et après l'opération, à différents intervalles. Nous n'avons pas trouvé d'étude publiée à ce sujet. Nous constatons que le QRSf est plus élevé dans la période post-opératoire que dans la période pré-opératoire, mais il ne s'allonge de façon significative que tardivement (après 35 jours), si l'on tient compte du bloc de branche droit qui, lui apparaît immédiatement après l'opération.
Dans le groupe 'suivi' (groupe de valeur statistique plus importante), l'étude du LAS40 montre un allongement significatif 35 jours après l'opération, tandis que la différence n'est pas significative avant ce délai. Pour ce même groupe, l'étude du RMS40 montre une diminution significative dans les périodes post-opératoires observées par rapport à la période pré-opératoire, tandis que la comparaison entre les différents intervalles après l'opération n'est pas significative.
Notre étude s'est penchée sur le temps écoulé entre l'opération et l'apparition des potentiels tardifs ventriculaires. A notre connaissance, aucune étude n'a encore été publiée sur ce sujet. Sur 20 cas suivis longitudinalement, 4 cas ont développé des potentiels tardifs, ces potentiels tardifs étaient absents avant l'opération, de même que 9 jours après l'opération et ils sont apparus dans un délai moyen de 25 jours après l'opération. Dans 2 cas, c'est après la réintervention qu'ils sont apparus.
Rappelons que les potentiels tardifs ventriculaires reflètent de zones lésées du myocarde où l'activation est retardée; ce retard de conduction a été fréquemment observé au niveau de l'infundibulum et du septum inter-ventriculaire d'admission, lieux du geste chirurgical. Cependant ce retard a été enregistré moins souvent ailleurs dans le ventricule droit et chez des patients non opérés témoignant d'une évolution naturelle vers de multiples zones de fibrose dans le ventricule droit (5, 22). Dans notre étude, l'apparition de potentiels tardifs est en théorie contemporaine de la cicatrisation des plaies chirurgicales. Une étude portant sur un plus grand nombre de patients avec un suivi rigoureux avec enregistrements consécutifs de l'ECG HA serait nécessaire, afin de mieux définir le délai d'apparition des potentiels tardifs.
La dispersion de l'espace QT (dQT) reflète les anomalies de dépolarisation et de repolarisation. Elle a été suggérée comme un marqueur non invasif de susceptibilité pour arythmies ventriculaires dans des étiologies variées.
Il a été démontré que la dispersion de l'espace QT est augmentée chez l'adulte ayant eu un infarctus du myocarde et qu'il existe un lien entre la présence d'une dQT pathologique et la survenue de troubles du rythme ventriculaire (32, 33, 34). GLANCY et coll. suggèrent que la dispersion du QT mesuré 4 semaines au moins après l'infarctus du myocarde peut identifier les patients à risque pour une mortalité subséquente (35).
En ce qui concerne les patients atteints de cardiomyopathies, plusieurs travaux ont suggéré que la dispersion de l'espace QT joue un rôle de marqueur pour définir les patients à risque potentiel de développer des arythmies ventriculaires (32, 36).
BUJA et coll. ont montré que la dispersion du QT est significativement augmentée chez les patients atteints de cardiomyopathie hypertrophiante, comparés à des sujets normaux et qu'elle permettait de différencier entre les deux groupes, avec ou sans risque d'arythmies ventriculaires malignes ou de mort subite (36).
Une étude récemment réalisée dans notre centre chez les nourrissons et les enfants atteints de cardiomyopathie d'étiologie variée a montré que la moyenne de dispersion de l'espace QT est significativement plus élevée dans le groupe des enfants atteints que dans le groupe des enfants normaux et que la prévalence d'une dispersion de l'espace QT pathologique est de 25 %, surtout chez les patients atteints de dystrophie musculaire de Duchenne (43).
En ce qui concerne les enfants ayant bénéficié d'une correction chirurgicale de tétralogie de Fallot, les études sur la dispersion de l'espace QT sont rares et leur implication pronostique est controversée. Plusieurs études ont montré que la dispersion du QT et de son composant JT sont significativement plus élevée chez les patients opérés que chez les patients normaux (7, 40, 41, 46).
BERUL et coll. ont proposé l'association d'un QRS prolongé et d'une dispersion du JT augmentée pour identifier les sujets à risque parmi les patients opérés. La dispersion du QT n'était pas significativement plus élevée chez les patients opérés porteurs d'arythmies ventriculaires que chez ceux n'ayant pas présenté de trouble du rythme ventriculaire (41).
Cependant, GATZOULIS et coll., dans une étude réalisée chez des adultes opérés de tétralogie de Fallot, ont trouvé que la dQT, la dJT et la dQRS étaient significativement plus élevées chez les sujets opérés présentant des tachycardies ventriculaires soutenues que chez ceux ne présentant pas de tachycardie ventriculaire. Ils ont suggéré qu'une combinaison d'un QRS >/= 180 ms, une dQT > 60 ms, une dQRS > 35 ms et une dJT > 60 ms identifient les malades opérés présentant des tachycardies ventriculaires soutenues (sensibilité 98,3 %, spécificité 100 %) (40).
DALIENTO et coll., dans une population adulte, ont mis en doute l'utilité de l'ECG HA pour l'identification des patients à risque d'arythmies ventriculaires sévères, chez les sujets opérés de tétralogie de Fallot. Par contre, la dispersion de l'espace QT chez les patients opérés était significativement plus élevée chez ceux qui présentaient des arythmies ventriculaires sévères, suggérant ainsi que la dispersion du QT est un marqueur d'instabilité électrique.
En moyenne, la dispersion de l'espace QT était augmentée chez les patients opérés, par rapport au groupe contrôle (sujets avec bloc de branche droit incomplet) ainsi que par rapport aux patients avec tétralogie de Fallot non opérée. La différence de dQT entre le groupe contrôle et le groupe porteur de tétralogie de Fallot non opérée n'était pas significative (7).
Dans une étude plus récente, DALIENTO et coll. ont noté que l'association entre dQT et volume du ventricule droit mesuré par échocardiographie en fin de diastole était très utile dans la stratification des patients à risque d'arythmies ventriculaires après correction chirurgicale de tétralogie de Fallot et dans leur suivi. Par contre, la dispersion de l'espace JT et du QRS ne montraient pas de différence significative entre plusieurs groupes, classifiés selon la sévérité de l'arythmie ventriculaire (46).
Notre étude s'est penchée sur la prévalence de la dispersion pathologique de l'espace QT chez les enfants atteints de tétralogie de Fallot, avant et après la chirurgie correctrice. A notre connaissance, aucune étude n'a encore été publiée sur cette prévalence. Parmi nos tracés réalisés avant l'opération, 37 % des patients étudiés présentent une dispersion pathologique de l'espace QT, tandis que ce pourcentage augmente à 63 % après l'opération, si on prend compte de tous les tracés post-opératoires. La moyenne de dQT est significativement plus élevée chez nos patients atteints de tétralogie de Fallot avant et après l'opération, que chez les enfants normaux. La moyenne de dQT et dJT est significativement plus élevée dans les tracés réalisés après l'opération que dans ceux réalisés avant l'opération.
La moyenne de dQT et dJT est significativement plus élevée dans les tracés de patients présentant des potentiels tardifs ventriculaires que dans les tracés réalisés après l'opération chez des patients où les potentiels tardifs sont négatifs. Parmi les 9 patients qui présentent des potentiels tardifs positifs , 8 ont également une dQT supérieure à 63 ms.
Nous avons étudié l'évolution de la dQT et de la dJT dans le temps, avant l'opération et à différents intervalles de l'opération. Nous avions l'arrière-pensée que leur évolution dynamique nous donnerait des informations sur la progression de la l'anomalie électrique. L'étude de la dispersion du QT et du JT ne montre pas de différence significative entre la période avant l'opération et 9 jours après l'opération. Cette différence devient significative 35 jours après l'opération. La moyenne de dQT et de dJT augmente de façon significative entre ces deux intervalles post-opératoires dans le groupe suivi longitudinalement.
Cependant, si l'on prend la totalité de patients, la différence de dQT et de dJT post-opératoire précoce et tardif n'est pas significative.
Aucun de nos patients n'a présenté de troubles du rythme ventriculaire sévère documentés, mais nous n'avons pas fait un Holter que chez quelques patients.
Limites de l'étude :
Outre le relativement petit nombre de patients, le facteur limitant est la courte durée du suivi. Il manque également un enregistrement Holter de routine, pour clarifier le liens entre les deux marqueurs (dQT, dJT et ECG HA) et la survenue spontanée d'arythmies ventriculaires.
En résumé, les marqueurs d'une arythmogénèse chez les enfants opérés par ventriculotomie pour tétralogie de Fallot inclut des anomalies des deux phases : la dépolarisation (étude de l'ECG HA) et la repolarisation (étude de la dispersion du QT et du JT). Il faudrait encore préciser leur progression à très long terme et au vu de l'évolution clinique pour établir leur lien potentiel avec la survenue d'arythmies malignes, voire la mort subite, étudier la corrélation entre ces deux facteurs et montrer leur valeur pronostique séparément ou en association dans le but de planifier un suivi de ces enfants de façon plus efficace et de décider d'un éventuel traitement anti-arythmique préventif.
On peut tout de même conclure que la dispersion anormale du QT est déjà présente dans un bon nombre de cas avant l'opération. Cette anomalie électrique fait donc partie de l'histoire naturelle de la tétralogie de Fallot, bien qu'une aggravation surviennent en post-opératoire.
En ce qui concerne les potentiels tardifs, ils n'apparaissent pas immédiatement après l'acte chirurgical, mais après un mois environs, en relation avec la formation des cicatrices.