Mieux comprendre les mécanismes inflammatoires
L’inflammation est un mécanisme naturel de défense qui peut se révéler dangereux lorsqu’il n’est plus régulé de manière efficace. Le développement de maladies auto-inflammatoires est ainsi caractérisé par une réaction anomale du système immunitaire inné. La fièvre méditerranéenne familiale (FMF) en constitue un bon exemple : cette maladie génétique, due à des mutations dans le gène MEFV du chromosome 16, est présente surtout parmi les populations de l’est et du sud du bassin méditerranéen. Elle est caractérisée notamment par des poussées inflammatoires survenant à intervalles variables. S’il n'existe actuellement aucun traitement curatif pour la FMF, la colchicine, un alcaloïde tricyclique, administré régulièrement, permettent de limiter l’apparition des crises et d’améliorer la qualité de vie des patients.
Mais comment la colchicine fonctionne-t-elle ? En ciblant des cytokines, des substances clés de la réaction inflammatoire. Il apparaît en effet que des cytokines bien particulière, appelées IL-1β et IL-18, sont finement régulés à travers des complexes protéiques appelés inflammasomes, dont le plus étudié est l’inflammasome NLRP3. Cet inflammasome est en effet nécessaire à la maturation et de la sécrétion de IL-1β et de l’IL-18. En étudiant les mécanismes régissant ce phénomène, Karim Brandt et son équipe, de la Faculté de médecine de l’UNIGE et du Service d’immunologie clinique des HUG, ont mis en lumière le rôle du cytosquelette dans la régulation de l’inflammasome NLRP3, permettant ainsi de mieux comprendre comment l’inflammation devient, dans certains cas, pathogène. Des résultats à lire dans Scientific Reports.
« Nous savons déjà que la colchicine a pour effet d’inhiber la production d’IL-1β à travers la régulation de l’assemblage de l’inflammasome NLRP3. Partant de là, nous nous sommes interrogés sur le rôle que peut avoir un autre membre du cytosquelette, l’actine », explique le Dr Brandt. « Grâce au fractionnement cellulaire et à l’immunoprécipitation, nous avons montré que l’inflammasome NLRP3 se localise, après activation, sur les filaments d’actine. » Cette localisation est importante pour la régulation négative de son activité, comme l’a démontré l’utilisation de perturbateurs des filaments d’actine, qui augmentent fortement la production d’IL-1β et d’IL-18. Toutefois, les polymères d’actine sont importants pour le contrôle de l’activité de l’inflammasome mais pas la polymérisation elle-même. La question de savoir comment l’inflammasome NLRP3 interagit avec les filaments d’actine a donc mené les chercheurs à explorer les protéines pouvant se lier au cytosquelette. Or, en 2013, deux protéines - FliI et LRRFIP2- avaient été identifiées comme répresseur de l’inflammasome NLRP3.Il s’avère que FliI fait partie d’une famille de protéines qui interagissent avec les filaments d’actine, et qui les clivent suivant une réaction dépendante du calcium. Les scientifiques genevois ont ainsi pu montrer que FliI et LRRFIP2 contrôlent la localisation de l’inflammasome NLRP3 sur les filaments d’actine et, par conséquent, également la production d’IL-1β.
Le calcium, élément essentiel
Cependant, l’augmentation de la concentration intracellulaire de calcium restait une part d’ombre de l’activation de l’inflammasome NLRP3. Bien connue, elle restait inexpliquée. « Nos travaux apportent une explication à ce phénomène » poursuit le Dr Brandt, « En effet, comme FliI appartient une famille de protéines dont l’activité de clivage des filaments d’actine dépend du calcium, nous avons émis l’hypothèse que l’augmentation des concentrations intracellulaires de calcium était nécessaire au clivage des filaments d’actine par FliI, permettant ainsi l’activation optimale de l’inflammasome NLRP3. L’expérience nous a donné raison. » L'accroissement des concentrations de calcium augmente donc la production d’IL-1β et d’IL-18 mais, également, le clivage des filaments d’actine. De plus, lorsque FliI et LRRFIP2 ne sont plus présent, l’élévation des niveaux de calcium n’a plus d’effet sur la production d’IL-1β/ IL-18 ni sur le clivage des filaments d’actine.
Ces résultats démontrent que l’inflammasome NLRP3 se localise sur les filaments d’actines afin de réguler son activation. L’augmentation intracellulaire du calcium permet la levée partielle de l’inhibition à travers la séparation de l’inflammasome et des filaments d’actines. Ce procédé permet une régulation fine de la production d’IL-1β et d’IL-18. Cette étude ouvre de nouvelles perspectives thérapeutiques pour les maladies inflammatoires où l’inflammasome NLRP3 joue un rôle prédominant.
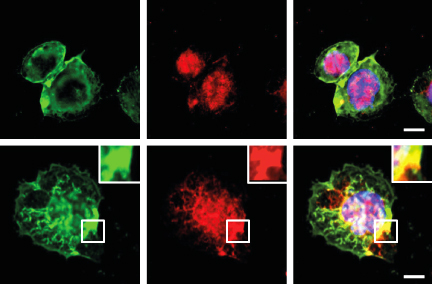
Illustration: Karim Brandt - HUG - UNIGE. Cellules THP-1 avec actine en vert, ASC (composant de l’inflammasome NLRP3) en rouge et ADN en bleu. Les cellules du haut sont au repos alors que celles du bas sont traitées avec un activateur de l’inflammasome NLRP3; l’ATP.
30 août 2016