Le PRN Biologie chimique, clap de fin
Après douze ans d’activité, le Pôle de recherche national « Biologie chimique » s’achève cette année. Il laisse en héritage une solide formation interdisciplinaire, des sondes mesurant la tension des membranes cellulaires ainsi que des plateformes technologiques de haute performance.
Voir la vie à l’œuvre dans toute la complexité de ses rouages moléculaires et cellulaires représente le pain – et l’émerveillement – quotidien des membres du Pôle de recherche national (PRN) Biologie chimique. Cohébergé depuis 2010 par l’Université de Genève et l’EPFL, ce consortium, dont les activités se termineront en novembre de cette année, a relevé le défi d’étudier dans ses plus infimes détails le fonctionnement – encore largement méconnu – des cellules vivantes. Pour ce faire, chimistes, biologistes et physicien-nes ont développé des approches et des outils inédits sous la forme de molécules permettant de visualiser et de contrôler en temps réel des phénomènes jusqu’alors inaccessibles, levant ainsi le voile sur des mécanismes cellulaires insoupçonnés. Pour soutenir cette quête, les scientifiques du PRN ont également développé plusieurs infrastructures technologiques et une formation qui resteront à la disposition de la communauté académique après la fin du programme.
Bilan des opérations avec l’ancien et le nouveau directeur du PRN Biologie chimique Howard Riezman et Robbie Loewith (un passage de flambeau opéré en novembre 2021), respectivement professeur au Département de biochimie (Faculté des sciences) et au Département de biologie moléculaire et cellulaire (Faculté des sciences).
Campus : Vous avez réussi à faire collaborer au sein des mêmes projets des chimistes, des biologistes et des physicien-nes, ce qui n’est pas commun. Était-ce une gageure ?
Howard Riezman : La chimie, la biologie et la physique sont en effet des domaines qui se sont spécialisés et séparés au cours des derniers quarante à cinquante ans, au point de se côtoyer sans interagir. Avec le PRN Biologie chimique, nous avons réussi à casser ce schéma, grâce à un gros travail de communication, de formation et de recrutement. Non seulement nos différents chercheurs et chercheuses travaillent désormais ensemble mais, en plus, nous en avons formé et engagé d’autres qui se positionnent à l’interface de ces disciplines. Nombre de ces scientifiques utilisent, dans le même laboratoire, les outils de la chimie (pour le développement de sondes) en même temps que ceux de la biologie (pour les tester sur des tissus vivants). Ils et elles sont également capables de converser avec des physicien-nes pour modéliser leurs systèmes et les exprimer sous forme d’équations. Ce sont surtout les doctorant-es et les postdoctorant-es qui ont porté cette évolution, suivis ensuite par tout le monde. De ce fait, il règne au sein de notre structure un état d’esprit totalement nouveau.
Robbie Loewith : Avoir réussi à créer cet esprit d’équipe entre des scientifiques venant de trois disciplines différentes représente probablement l’accomplissement le plus important que nous laissons en héritage. Nous ne sommes évidemment pas les seuls à encourager l’interdisciplinarité dans nos projets. C’est une injonction que l’on entend partout en science. Mais nous sommes parmi les rares à l’avoir mise en œuvre de manière aussi aboutie. Et aujourd’hui, nous en mesurons les avantages. Le fait d’aborder un projet scientifique avec des outils venus de différentes disciplines permet d’aller plus loin, de se poser plus de questions, d’ouvrir son esprit.
Comment les avez-vous fait travailler ensemble ?
HR : Au début, nous avons décidé de ne financer que les projets ayant une dimension interdisciplinaire. Il se trouve que les différentes équipes y ont rapidement trouvé leur compte. Dès le deuxième appel à projets, les équipes ont spontanément intégré cette dimension dans leur plan.
RL : Depuis 2015, nous disposons également d’un programme de master personnalisé qui permet d’initier les étudiants et les étudiantes aux différentes techniques de biologie et de chimie. Nous menons un entretien individuel avec chaque candidat-e et nous établissons un plan d’études sur mesure en mettant l’accent sur les matières qu’il ou elle maîtrise le moins afin de compléter sa formation.
L’un des objectifs du PRN était le développement d’outils permettant d’étudier en direct le fonctionnement biochimique de cellules encore vivantes. Y êtes-vous parvenus ?
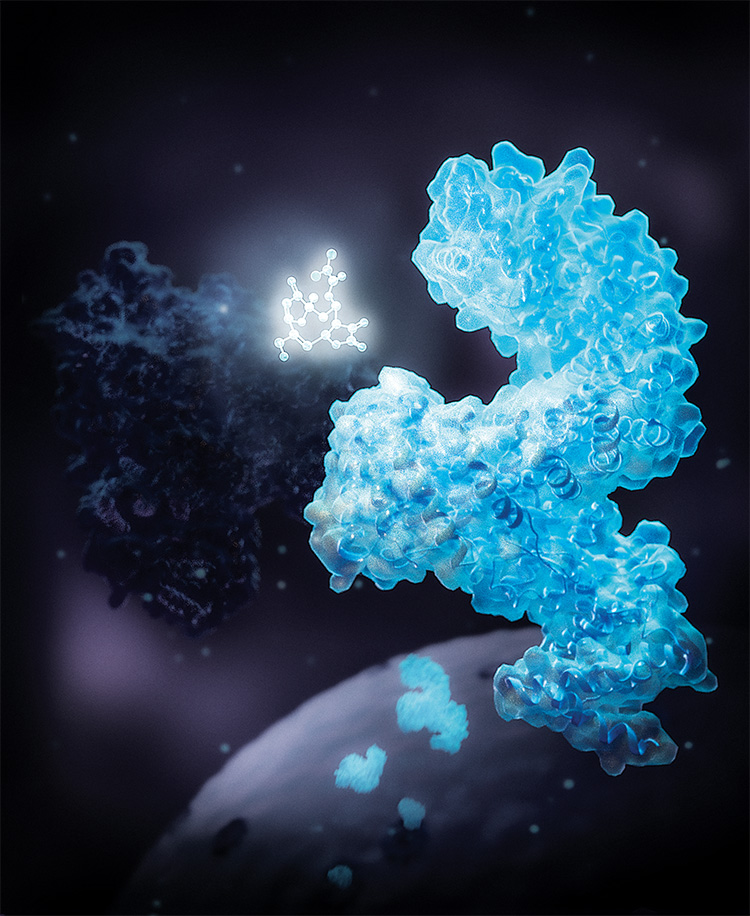
HR : Oui. La découverte emblématique du PRN Biologie chimique est sans doute la sonde Flipper (Flipper-TR®). Ou plutôt les sondes Flipper, car il en existe plusieurs aujourd’hui. C’est Stefan Matile, professeur au Département de chimie organique, qui a imaginé le concept en s’inspirant des caroténoïdes, des pigments présents dans les carottes et chez de nombreux organismes vivants, dont le homard (lire l'article). Après un certain nombre d’essais, Stefan Matile et ses collaborateurs et collaboratrices ont réussi à développer une petite molécule qui peut adopter deux configurations possibles, chacune ayant des propriétés fluorescentes différentes. Ces sondes sont conçues de telle façon qu’elles peuvent s’incorporer dans la membrane cellulaire. En fonction de la tension qui y règne, elles changent de forme. En mesurant les variations de la fluorescence qui en découlent, on peut suivre les changements de tension membranaire dans des cellules vivantes.
À quoi cela sert-il de connaître la tension des membranes ?
HR : Les membranes en général constituent un sujet important pour la biologie chimique car d’autres approches, telles que la biologie moléculaire et la génétique, ne sont pas en mesure de traiter la grande diversité des composants de cette structure, en particulier les lipides. La tension membranaire est impliquée dans de très nombreux processus biologiques, comme la division cellulaire ou le transport de molécules entre l’intérieur et l’extérieur des cellules. Mesurer cette grandeur physique sur une entité vivante aussi petite était jusqu’ici impossible sans passer par des organismes génétiquement modifiés développés spécifiquement pour chaque expérience. Une opération longue et complexe, donc très peu utilisée. Notre sonde est, au contraire, simple à utiliser. Lorsqu’on l’ajoute à des cellules vivantes mises en culture, elle va automatiquement se placer aux bons endroits. Aujourd’hui, Spirochrome, une start-up basée à Schaffhouse et créée en étroite collaboration avec des membres du PRN Biologie chimique, produit et commercialise les sondes Flipper.
RL : La tension de la membrane cellulaire doit être maintenue dans une fourchette très étroite. Si, par exemple, elle est trop élevée, la cellule explose. Ce paramètre est donc continuellement contrôlé par la cellule qui peut activer, si nécessaire, la biosynthèse de nouveaux composants membranaires pour compenser. Dans ce contexte, le travail de l’équipe de Howard Riezman, d’Aurélien Roux et de la mienne a montré qu’une augmentation ou une diminution de la tension ne déclenche pas les mêmes voies de signalisation. Notre objectif consiste actuellement à identifier ces dernières et à comprendre comment elles influencent la physiologie et le métabolisme de la cellule.
La sonde est-elle adaptée à tous les types de cellules ?
RL : Oui. La première version de Flipper fonctionne aussi bien sur des levures que sur des cellules animales. Les applications sont innombrables. Il existe par exemple des champignons, nuisibles pour certaines cultures, qui possèdent un système appelé appressorium. Ce dispositif, exploitant une tension membranaire qui peut atteindre des niveaux assez élevés, envoie une protéine-pointe qui ouvre la voie au champignon pour entrer dans la cellule de la feuille qu’il veut parasiter. Il ne fait aucun doute que les sondes Flipper pourraient être utiles à l’étude de ce phénomène à l’origine d’importantes pertes économiques.
HR : Depuis, de nombreuses autres versions de Flipper ont été développées pour cibler non pas la membrane extérieure de la cellule mais celle de ses organelles, beaucoup plus petites. Trois modèles sont actuellement commercialisés. Le premier est adapté aux mitochondries (les « centrales énergétiques » des cellules), le deuxième au réticulum endoplasmique (le siège principal de la synthèse des lipides et des protéines) et le troisième aux lysosomes (les centres de recyclage). Il en existe encore d’autres en phase de commercialisation ou de développement.
Le PRN a-t-il permis de développer d’autres outils biochimiques ?
HR : Oui, plusieurs. L’un de ces outils permet de délivrer plus efficacement des composés à l’intérieur des cellules, ce qui intéresse beaucoup les firmes qui fabriquent les vaccins à ARN. Un autre consiste à fabriquer des molécules fluorescentes qui clignotent. Cette particularité permet notamment une localisation beaucoup plus précise dans la cellule. Je peux vous citer également des composés que l’on enferme dans une « cage » moléculaire. Cette capsule entre dans une cellule avant d’être ouverte grâce à une impulsion lumineuse, libérant le composé exactement à l’endroit choisi. On peut alors suivre de manière spatio-temporelle la cascade de réactions biochimiques qui s’ensuit et l’analyser. On s’est rendu compte, par exemple, que suivant l’endroit dans la cellule où le composé est relâché, la voie métabolique qui en découle n’est pas la même. La cascade de réactions a beau aboutir au même endroit, elle n’entraîne pas l’activité de la même enzyme. On ne sait pas vraiment pourquoi. Ce qui est sûr, c’est que les molécules ne se déplacent pas dans la cellule par simple diffusion. Elles semblent suivre des chemins précis, comme si elles étaient guidées. C’est totalement nouveau.
C’est surtout plus compliqué que l’on pensait…
HR : En effet. Il existe des diagrammes aussi grands que des posters qui montrent les principales réactions biochimiques connues qui ont lieu dans les cellules. Ces enchevêtrements invraisemblables de flèches, de symboles et de formules chimiques sont la hantise des étudiant-es qui sont obligé-es de les apprendre. Et, malheureusement pour elles et eux, la réalité est encore bien plus compliquée que cela.
Le PRN a créé en 2010 la plateforme technologique Access. De quoi s’agit-il ?
HR : Access (Academic Chemical Screening for Switzerland) est une plateforme de criblage. Elle permet d’identifier les composés chimiques qui ont les propriétés que l’on recherche. La plateforme est installée à l’EPFL. Elle propose des tests cellulaires in vitro à partir d’une bibliothèque de plus de 100 000 composés provenant de diverses sources commerciales. Cette collection comprend notamment des principes actifs de médicaments et des composés naturels. Access gère aussi la Collection chimique suisse qui possède des composés uniques issus de divers laboratoires de chimie suisses et qui ne peuvent être trouvés nulle part ailleurs.
RL : En 2015, une antenne d’Access a été créée au Département de biochimie de l’Université de Genève. Complémentaire à celle de Lausanne, elle offre des criblages d’imagerie à haut contenu et/ou à haut débit à l’aide d’une infrastructure automatisée. Cette plateforme technologique dispose non seulement d’instruments très sophistiqués mais aussi d’un savoir-faire très pointu, notamment dans le domaine de la génétique chimique, le domaine qui utilise de petites molécules pour perturber un système biologique et ainsi révéler des informations sur le système étudié.
À quoi sert une telle installation ?
HR : Nous l’avons par exemple utilisée dans le cadre d’une recherche sur la maladie de Cohen (une maladie génétique rare caractérisée, entre autres, par une déficience intellectuelle et des anomalies faciales). Chez les patients et les patientes souffrant de cette condition, il manque une protéine spécifique, ce qui provoque une désorganisation et un dysfonctionnement de l’appareil de Golgi, une organelle qui se charge notamment du transfert et du tri des molécules dans les cellules. Nous avons donc passé au crible un grand nombre de molécules pour essayer de trouver celles qui sont capables de remettre cette organelle en bon état. Les installations et le personnel d’Access ont permis de développer toutes les étapes de l’opération, dont celle de la préparation de la cible sur laquelle sont testés les composés. Nous avons ainsi pu identifier une trentaine de candidats dont un qui semble intéressant car dépourvu, à première vue, d’effets secondaires sur les cellules. Nous allons donc pouvoir le tester sur des modèles de souris. Si nécessaire, nous pourrons revenir vers Access pour analyser par ordinateur le composé en question, le modifier pour l’améliorer ou encore en identifier d’autres ayant une activité similaire.
Un PRN se doit également de favoriser le transfert de technologie du monde de la recherche vers celui de l’entreprise. Qu’en est-il à ce propos ?
HR : Le PRN Biologie chimique a créé, développé et suscité l’intérêt autour d’un workshop unique en Suisse appelé Bench2biz (bench2biz.ch). Basé sur une idée venue des États-Unis, cet atelier de deux jours et demi offre une évaluation objective et personnalisée à des projets de start-up ayant trait à des domaines scientifiques de pointe, par une équipe comprenant des personnes issues du milieu entrepreneurial et scientifique. Destiné à toute la communauté scientifique helvétique, il a lieu une fois par an depuis 2014. Dix autres Pôles de recherche nationaux sont actuellement partenaires du projet. Une vingtaine de start-up soutenues dans leurs premiers pas par Bench2biz sont actuellement en activité. Nous ne sommes plus à la tête de cette initiative mais nous sommes très fiers d’avoir été à son origine.
Le PRN a-t-il aussi été efficace dans sa mission visant à assurer l’égalité des chances de ses membres et à promouvoir les carrières des femmes ?
RL : Oui, bien sûr. Monica Gotta, professeure au Département de physiologie cellulaire et métabolisme, a supervisé de nombreuses initiatives pour la promotion des carrières des jeunes chercheurs et chercheuses, pour encourager les jeunes filles à choisir une carrière en science ou encore pour assurer l’équilibre entre travail et vie privée. Nous avons aussi beaucoup travaillé pour mettre les femmes scientifiques en avant et notre gestion du réseau a pris soin d’intégrer l’égalité des genres dans tous les aspects de notre fonctionnement. Certaines de ces initiatives ont rencontré un franc succès auprès de nos publics cibles et ont été reprises par d’autres Pôles de recherche à travers la Suisse. Nous avons atteint 25% de professeures, un chiffre supérieur au taux moyen en sciences (15% selon les statistiques nationales de 2017). Mais certaines d’entre elles ont rencontré de grandes difficultés notamment pour trouver de la place pour leurs enfants dans une crèche. Genève manque cruellement d’infrastructures en la matière et les obstacles administratifs sont nombreux. Certaines chercheuses ont failli renoncer à nous rejoindre pour cette raison. Le PRN a fait ce qu’il a pu, notamment en trouvant une crèche privée et en aidant au financement.
