Naissance de la vision, de la rétine au cerveau
En décodant les mécanismes génétiques qui contrôlent les neurones du système visuel, des chercheurs de l’UNIGE dévoilent les premières étapes de la construction de la vision, ouvrant ainsi la voie à une médecine régénérative de l’œil.
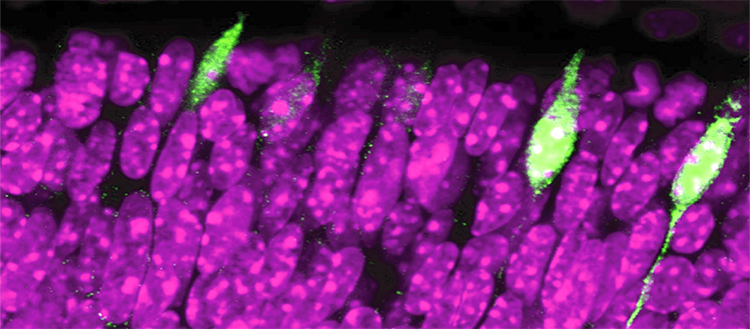
Photorécepteurs responsables de la vision en couleur. En séquençant une cellule à la fois, les chercheurs ont identifié un gène (Rbp4) présent dans un petit nombre de cellules (en vert). En violet, les photorécepteurs dont le gène Rbp4 n’est pas activé. © UNIGE, Pierre Fabre
Comment la rétine se forme-t-elle? Et comment les neurones se différencient-ils pour devenir l’une des pièces composant le système visuel? En s’intéressant aux premières étapes de ce processus complexe, des chercheurs de l’Université de Genève (UNIGE), en collaboration avec l’École polytechnique fédérale de Lausanne (EPFL), ont identifié les programmes génétiques gouvernant d’une part la naissance des différents types de cellules de la rétine, et d’autre part leur branchement à l’endroit exact du cerveau où ils pourront accomplir leur tâche. De plus, la découverte de plusieurs gènes régulant la transmission des signaux permet d’envisager la possibilité d’un coup de pouce à la régénération du nerf optique en cas de maladie neurodégénérative. Des résultats à découvrir dans le journal Development.
Le système visuel des mammifères est composé de différents types de neurones qui doivent chacun trouver leur place pour que le cerveau puisse transformer les stimuli reçus par l’œil en images. Il y a les photorécepteurs, qui détectent la lumière, les neurones du nerf optique, qui envoient l’information au cerveau, les cellules des réseaux cérébraux, chargées de former des images, ou encore les interneurones, qui assurent les connexions entre les autres cellules. Ces neurones sont tous issus de cellules progénitrices qui, non encore différenciées lors des phases initiales du développement embryonnaire, sont capables de donner naissance aux différentes catégories de neurones spécialisés. Pour mieux comprendre le déroulement exact de ce mécanisme et identifier les gènes à l’œuvre pendant la construction de la rétine, les chercheurs ont étudié la dynamique de l’expression des gènes dans des cellules prises isolément. «Pour suivre l’activité des gènes dans les cellules et comprendre la spécification précoce des neurones rétiniens, nous avons séquencé plus de 6000 cellules pendant le développement de la rétine, afin de mener des analyses bio-informatiques à grande échelle,» explique Quentin Lo Giudice, doctorant au Département des neurosciences fondamentales de la Faculté de médecine de l’UNIGE et premier auteur de cet article.
Cartographie d’un système en construction
En collaboration avec Gioele La Manno et Marion Leleu de l’EPFL, les chercheurs ont étudié le comportement des progéniteurs pendant le cycle cellulaire, puis lors de leur différenciation progressive. Les scientifiques ont alors cartographié de façon très précise les différents types cellulaires de la rétine en développement, ainsi que les changements génétiques qui surviennent au cours des premières étapes de ce processus. «Au-delà de leur «âge» – soit à quel moment de la vie embryonnaire ils ont été générés – la diversité des neurones découle de leur position dans la rétine, qui les prédestine à une cible précise dans le cerveau, explique Pierre Fabre, chercheur au Département des neurosciences fondamentales de la Faculté de médecine de l’UNIGE, qui a dirigé ces travaux. De plus, en observant isolément ces neurones et en suivant l’activation séquentielle de leurs gènes, nous avons pu reconstruire un arbre de différenciation génétique où les progéniteurs se divisent, puis s’orientent vers un type cellulaire ou un autre.»
Les chercheurs ont ensuite procédé à une deuxième analyse: si l’œil droit connecte essentiellement à la partie gauche du cerveau – et inversement –, une petite fraction de neurones de l’œil droit effectue des connexions dans la partie droite du cerveau. En effet, toutes les espèces ayant deux yeux avec un champ visuel qui se recoupe, comme les mammifères, doivent pouvoir mélanger les informations en provenance des deux yeux dans la même partie du cerveau. Ce regroupement rend possible la vision binoculaire permettant de percevoir les profondeurs ou les distances. «Connaissant ce phénomène, nous avons «marqué» les cellules individuellement afin de suivre chacune d’entre elles tout au long de leur progression et jusqu’à leur place finale dans le système visuel,» indique Quentin Lo Giudice. En comparant l’activation génétique de ces deux populations neuronales, les chercheurs ont découvert 24 gènes qui pourraient être essentiels à une vision tridimensionnelle.
Vers la médecine régénérative
Mais avant même que les neurones arrivent dans le cerveau, ils doivent sortir de la rétine par le nerf optique. La dernière partie de cette étude a permis d’identifier les molécules capables de guider les neurones sur le bon chemin. Et ces mêmes molécules pourraient permettre la pousse initiale des axones, – la partie des neurones qui transmet les signaux électriques vers les synapses et assurent le passage de l’information d’un neurone à l’autre, ainsi qu’une vingtaine de gènes qui contrôlent ce processus. Cette découverte est prometteuse dans l’idée d’une médecine régénérative.
«Si le nerf optique est coupé ou endommagé, suite à un glaucome par exemple, nous pourrions imaginer réactiver ces gènes qui ne sont habituellement actifs que lors de la phase de développement embryonnaire. En stimulant la pousse des axones, nous pourrions permettre aux neurones de rester connectés et de survivre,» explique Pierre Fabre, qui ambitionne de lancer un projet de recherche sur cette thématique. Les capacités de régénération des neurones sont très faibles, mais elles existent néanmoins et il faut trouver le moyen de les encourager. Des stimulations génétiques de la moelle épinière endommagée après un accident procèdent d’ailleurs de la même idée et commencent à montrer leurs premiers succès.
