Comment fabriquer des protéines à la bonne vitesse
Grâce à une technique d’observation dynamique de la synthèse des protéines, des scientifiques de l’UNIGE ont décrypté les mécanismes génétiques régissant la vitesse de traduction de l’ARN messager.
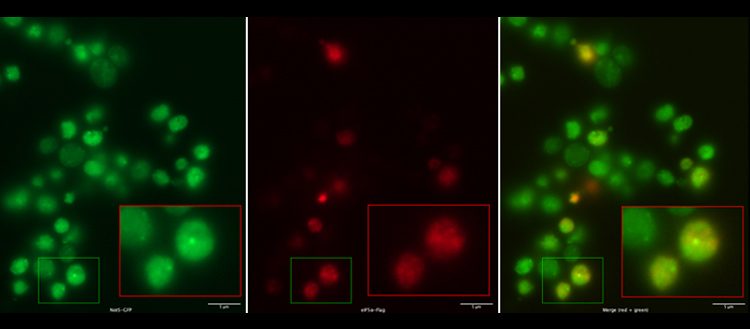
Les condensats de Not5 (en haut, en vert) excluent un facteur d’accélération de la traduction de l’ARNm (visible en rouge, au milieu). En bas, les images fusionnées: le jaune indiquerait une co-localisation; lorsque les condensats sont verts, le facteur d’accélération de la traduction de l’ARNm est absent. © ©UNIGE – Laboratoire Collart
Chez tous les organismes eucaryotes, le matériel génétique est stocké dans le noyau cellulaire sous forme d’ADN. Pour être utilisé, ce programme est d’abord transcrit en ARN messager dans le cytoplasme des cellules, puis traduit dans les ribosomes, de petites machines capables de décoder les ARN messagers pour synthétiser les protéines qui conviennent. Cependant, la vitesse avec laquelle ce mécanisme se déroule n’est pas uniforme : elle doit s’adapter pour permettre à la protéine d’adopter la bonne configuration. En effet, une dérégulation du rythme de production entraîne des défauts structurels. Les protéines, alors inutilisables, ne sont pas correctement repliées et s’agrègent, devenant toxiques pour la cellule. En analysant la vitesse d’action des ribosomes dans des cellules de levure, une équipe de l’Université de Genève (UNIGE), en collaboration avec l’Université de Hambourg, est parvenue à démontrer que le rythme de synthèse des protéines est modulé par des facteurs de régulation qui modifient à loisir la vitesse de traduction de l’ARN messager en protéines. Des résultats à découvrir dans la revue Cell Reports.
Les protéines sont des structures en 3D qui, pour agir, doivent s’imbriquer les unes dans les autres ou interagir avec des partenaires. En cas de défaut, les protéines s’agrègent, devenant toxiques pour les cellules et potentiellement pathologiques. Ce phénomène s’observe dans de nombreuses maladies neurodégénératives, comme la maladie d’Alzheimer ou encore la sclérose latérale amyotrophique. «Nous savions déjà que le rythme de fabrication des protéines se modifiait selon les besoins : parfois rapide, parfois très lent», explique Martine Collart, professeure au Département microbiologie et médecine moléculaire de la Faculté de médecine de l’UNIGE, qui a dirigé ces travaux. «Par contre, nous ignorions encore comment ce mécanisme était contrôlé.»
Profilage des ribosomes
Afin de comprendre ce processus, les scientifiques ont utilisé une technique très novatrice et encore peu connue : le profilage de ribosomes. «Cette méthodologie permet d’isoler la position des ribosomes à un moment donné dans la cellule», explique Olesya Panasenko, chercheuse dans le laboratoire de Martine Collart et responsable de la plateforme de recherche facultaire BioCode: RNA to Proteins utilisant cette technique. «Cela consiste à dégrader, à un moment précis, tout l’ARN qui n’est pas protégé par le ribosome, pour conserver uniquement la petite partie d’intérêt, puis de séquencer cet ARN afin de définir combien de ribosomes étaient à quelle position à ce moment-là. Répété dans le temps, cela indique la vitesse à laquelle le mécanisme se déroule.»
Les scientifiques ont ainsi observé la vitesse et la dynamique de production des protéines dans des cellules de levure naturelle ainsi que dans des levures génétiquement modifiées, afin d’identifier d’éventuelles différences en fonction du code génétique. En effet, lors de la synthèse, de petits condensats formés d’ARN et de protéines apparaissent dans la cellule, avec pour fonction de ralentir le rythme de production du ribosome. «Or, la formation de ces condensats dépend de la présence ou non de facteurs de régulation, appelés Not, qui ont un rôle de décélérateur», détaille Martine Collart. «En leur absence, le mécanisme accélère aux mauvais endroits et le résultat donne des protéines agrégées.»
Une vitesse régulée par le code génétique
Ainsi, les facteurs Not s’associent avec le ribosome à des moments précis pendant la synthèse des protéines, pour ralentir le ribosome en cours de traduction en condensant l’ARN et la protéine naissante. «On peut se demander si ce mécanisme de régulation est affecté lors de maladies neurodégénératives ou avec l’âge», s’interrogent les auteur-es. Il serait donc possible que des perturbations minimes, prises une à une, aient finalement un effet cumulatif important au fil du temps.
