Modéliser des poumons pour limiter les essais sur des souris
L’UNIGE décerne son prix 3R au créateur d’un modèle cellulaire qui, en reproduisant une infection pulmonaire, a permis l’identification d’un traitement prometteur.
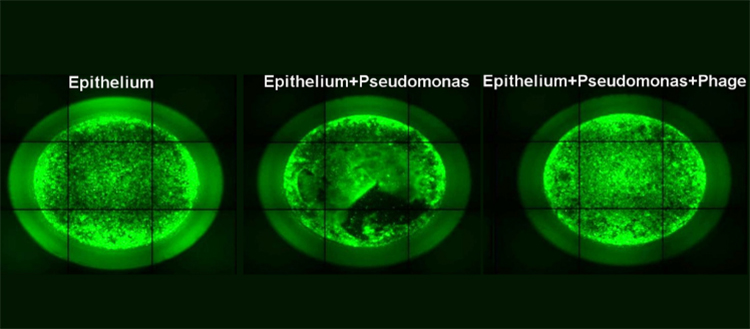
Image par microscopie à fluorescence d’un épithélium pulmonaire humain modèle: seule, lors d’une infection par P. aeruginosa, puis traitée par phagothérapie. © UNIGE – Thilo Köhler
Pseudomonas aeruginosa est une bactérie responsable de nombreuses infections pulmonaires, en particulier chez les personnes atteintes de mucoviscidose ou vivant avec un système immunitaire affaibli. L’émergence de résistance à la plupart des antibiotiques courants, devenus presque inefficaces, rend nécessaire le développement de nouvelles thérapies afin de combattre ces infections potentiellement mortelles. Des scientifiques de l’Université de Genève (UNIGE) ont mis au point un modèle ex vivo élaboré à partir de cellules pulmonaires humaines, permettant de tester l’efficacité de plusieurs traitements: des antibiotiques, des bactériophages (des virus capables d’infecter et de détruire les bactéries) ou une combinaison des deux. Précis et proche de la réalité clinique, ce modèle est récompensé par le prix 3R de l’UNIGE, qui distingue depuis 2016 une chercheuse ou un chercheur de l’UNIGE pour sa contribution au principe des 3R, pour «réduire», «raffiner», «remplacer». Les 3R visent à réduire le nombre d’animaux utilisés en expérimentation, à raffiner la méthodologie pour minimiser les contraintes subies par l’animal tout en améliorant la qualité des résultats obtenus, et à remplacer le modèle animal par des méthodes alternatives dès que cela est possible. Ces recherches sont à découvrir dans un article publié en août 2020 dans la revue Frontiers in Microbiology.
«Pour faire de nouvelles découvertes et permettre le développement de nouvelles thérapies, la recherche scientifique s’appuie sur plusieurs méthodes d’investigation. A l’UNIGE, tout projet scientifique prévoyant l’expérimentation animale est évalué afin d’améliorer le bien-être des animaux en expérience, de réduire le nombre d’animaux nécessaire pour atteindre les buts du projet, et de remplacer l’utilisation des animaux par des méthodes alternatives quand cela est possible. Notre engagement dans le principe des 3R est fort et valorisé au travers du Prix 3R», souligne Daniele Roppolo, directeur de l’expérimentation animale de l’UNIGE. Le prix 3R de l’UNIGE 2021 sera remis le mardi 8 juin 2021 à 17h, dans le cadre de la Cérémonie de remise des prix de la Commission des prix de la Faculté de médecine, diffusée en ligne.
Contrer les bactéries résistantes aux antibiotiques
Très répandue et responsable de nombreuses infections nosocomiales, Pseudomonas aeruginosa reste pourtant l’une des bactéries les plus difficiles à traiter. «L’apparition de bactéries de plus en plus résistantes aux antibiotiques devient un fléau mondial», souligne Thilo Köhler, chercheur aux départements de microbiologie et médecine moléculaire et de médecine de la Faculté de médecine de l’UNIGE, qui a dirigé ces travaux, et lauréat du prix 3R de l’UNIGE. «Il est donc urgent de renforcer notre arsenal thérapeutique avec d’autres outils, dont les bactériophages.»
Les bactériophages sont des virus infectant spécifiquement les bactéries, et donc potentiellement utilisables pour combattre les infections causées par ces dernières. Connu depuis près d’un siècle, leur usage est cependant tombé en désuétude. Leur intérêt thérapeutique n’a resurgi que récemment, avec l’apparition de bactéries multi-résistantes et le manque de nouveaux antibiotiques pour les combattre. Les phages sont en effet actifs sur des bactéries multi-résistantes et ont l’avantage d’être spécifiques à un seul type de bactérie, ménageant ainsi notre microbiote. En outre, les phages s’autorégulent en fonction de la présence ou non de cette bactérie. «Cependant, ils peuvent également engendrer des résistances chez les bactéries», indique Thilo Köhler. «Nous avons donc décidé de les tester seuls, puis combinés avec des antibiotiques, dans l’idée de découvrir le traitement le plus efficace et le moins à même de déclencher ces mécanismes de défense.» Jusqu’à présent en effet, les phagothérapies n’avaient été testées que sur des périodes de moins de 24h; leurs effets à plus long terme, ainsi que sur le système immunitaire de l’hôte, n’avaient jamais été étudiés dans le cas d’une infection avec P. aeruginosa.
Un modèle cellulaire au plus proche d’un vrai poumon
Pour ce faire, les scientifiques ont utilisé un modèle ex vivo de cultures de cellules épithéliales pulmonaires humaines, dont la fonction est de former une barrière protectrice et d’assurer l’hydratation du mucus. Deux types de cellules ont été utilisées: des cellules saines et des cellules atteintes d’une mutation du gène cftr, responsable de la mucoviscidose.
«A partir d’une technologie existante, nous avons créé un nouveau modèle adapté à un contexte pulmonaire dans le cadre d’une infection aux Pseudomonas», explique Thilo Köhler. «De plus, nous avons utilisé des cellules reproduisant la mucoviscidose afin d’établir si le traitement que nous proposons pourrait aussi soigner efficacement les infections pulmonaires affectant ces malades.» En outre, l’évaluation dans un modèle animal de l’efficacité d’une combinaison phage/antibiotique menée par une autre équipe valide le modèle ex vivo utilisant des cellules humaines: celui-ci est aussi efficace, tout en s’approchant au plus près de la réalité clinique. Il pourrait donc être adapté à d’autres types d’infection pulmonaires pour étudier l’efficacité de nouveaux traitements sans recours à des animaux.
Combiner pour mieux traiter
Lors d’une infection par P. aeruginosa, les cellules épithéliales pulmonaires ne sont rapidement plus capables de maintenir la barrière épithéliale protectrice. Avec un traitement à base de différents types de phages ou avec un antibiotique (la ciprofloxacine) quelques heures après l’infection, la barrière épithéliale reste imperméable. L’effet est donc réel, mais pas définitif: 72h plus tard, les bactéries ont en effet recommencé à se multiplier, indiquant l’existence d’un mécanisme de résistance.
En revanche, quand les deux traitements sont combinés, les cellules épithéliales sont beaucoup mieux protégées: la plupart des bactéries disparaissent et les quelques survivantes sont moins virulentes. «Nos résultats sont positifs dans le modèle de cellules saines comme dans celui utilisant des cellules avec une mutation du gène cftr, une très bonne nouvelle!» se réjouit Thilo Köhler. De plus, ce type de traitement n’induit pas de réaction inflammatoire, montrant sa grande acceptabilité par l’organisme qui ne cherche pas à se défendre contre le médicament. Cette étude démontre donc l’efficacité d’un tel traitement qui devra être confirmée lors de futures études cliniques.
