Suivre les protéines à la trace au cœur des cellules
Une équipe de l’UNIGE a pu, pour la première fois, suivre avec précision le chemin parcouru par une protéine au sein de la cellule, ouvrant la voie à l’étude du réseau de transport et de distribution des éléments vitaux nécessaire à sa survie.
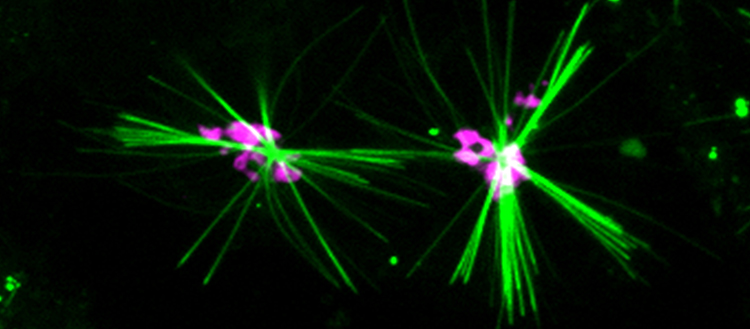
Un colorant précipitant génère des cristaux fluorescents (verts) dans les cellules vivantes, qui enregistrent le mouvement de la protéine motrice kinésine-1 le long des microtubules. Les cristaux sont centrés dans l’appareil de Golgi (magenta) et s’étendent vers la périphérie des cellules, ce qui correspond à l’activité de transport de la kinésine-1. © UNIGE
Pour se maintenir en vie, la cellule doit fournir à ses différents organites tous les éléments énergétiques dont ils ont besoin et qui sont formés dans l’appareil de Golgi, son centre de production et de redistribution de lipides et de protéines. Mais comment les protéines qui transportent ces cargaisons – les kinésines – trouvent-elles leur chemin et la direction à prendre au sein du « réseau routier» de la cellule pour les acheminer au bon endroit? Pour répondre à cette question, des chimistes et biochimistes de l’Université de Genève (UNIGE) ont mis au point un colorant chimique fluorescent qui, pour la première fois, permet de suivre l’activité de transport d’une protéine motrice spécifique dans une cellule. Une découverte à lire dans la revue Nature communications.
«Tout est parti d’une recherche qui ne s’est pas passée comme prévu, s’amuse Nicolas Winssinger, professeur au Département de chimie organique de la Faculté des sciences de l’UNIGE. Au départ, nous voulions développer une molécule qui permettrait de visualiser le niveau de stress de la cellule, c’est-à-dire quand elle accumule trop d’oxygène actif. Lors de l’expérience, la molécule n’a pas fonctionné, mais a cristallisé. Pourquoi? Qu’étaient ces cristaux?»
Trois hypothèses se sont imposées à l’équipe de recherche qui, pour les vérifier, a fait appel à l’expertise de Charlotte Aumeier, professeure au Département de biochimie de la Faculté des sciences de l’UNIGE. La première hypothèse suggérait que la cristallisation était due aux microtubules qui se polymérisent. «Les microtubules sont de petits tubes rigides qui peuvent grandir ou rétrécir et qui constituent «le réseau routier» qui permet aux molécules de se déplacer dans la cellule», explique Charlotte Aumeier. La deuxième hypothèse rendait l’appareil de Golgi responsable de cette réaction chimique. Enfin, la dernière possibilité suggérait que les cristaux étaient le résultat des petits pas fait par les protéines de kinésine dans les microtubules lors de leurs déplacements au sein de la cellule.
Le petit poucet des biochimistes
Pour vérifier ces différentes options, l’équipe de l’UNIGE s’est associée à l’Institut national de santé (NIH) de Bethesda (USA), spécialisé dans la microscopie électronique. «Nous avons en premier lieu recréé des microtubules que nous avons purifiés pendant 14 heures, détaille Charlotte Aumeier. Pour les kinésines, les protéines moteur qui se déplacent dans les microtubules et transportent les cargaisons, nous sommes partis de bactéries.» Les scientifiques ont ensuite constitué une vingtaine de mélanges différents contenant la petite molécule QPD, présente systématiquement dans les cristaux, et ont observé quelle solution fonctionnait. «Nous voulions savoir ce qui était nécessaire à la formation des cristaux. Les microtubules? La kinésine? Une autre protéine?», s’interroge Nicolas Winssinger.
Suite aux diverses expériences, l’équipe a découvert que la cause de la formation de ces cristaux était une des 45 sortes de kinésine présente dans la cellule. «A chaque petit pas que fait cette protéine de kinésine dans le microtubule, elle utilise de l’énergie qui laisse une trace reconnue par la molécule QPD, continue le chercheur genevois. C’est de cette reconnaissance que naissent les cristaux.» Ainsi, les cristaux sont chimiquement laissés derrière le passage de la kinésine, qui peut être suivie à la trace par les scientifiques, tel le petit poucet.
L’ouverture d’un nouveau champ d’étude
«Jusqu’à aujourd’hui, il n’était pas possible de suivre une protéine en particulier. Les techniques actuelles ne parvenant pas à séparer les kinésines individuellement, nous ne pouvions pas observer quel chemin elles prenaient avec précision, continue Charlotte Aumeier. Grâce au développement de notre nouveau colorant chimique fluorescent, nous pouvons observer en détail le comportement d’une protéine, quelle route elle choisit, sa direction ou encore son chemin de préférence.» Pour la première fois, les scientifiques peuvent visualiser le parcours de marche des protéines motrices et étudier la question fondamentale de l’activité de transport et de la distribution des cargaisons dans les cellules.
