Le rôle des lipides dans l’apparition de la maladie d’Alzheimer
Un consortium européen coordonné par l’UNIGE décrypte comment une mutation de la protéine APOE modifie le transport des lipides et contribuerait à l’apparition de la maladie.
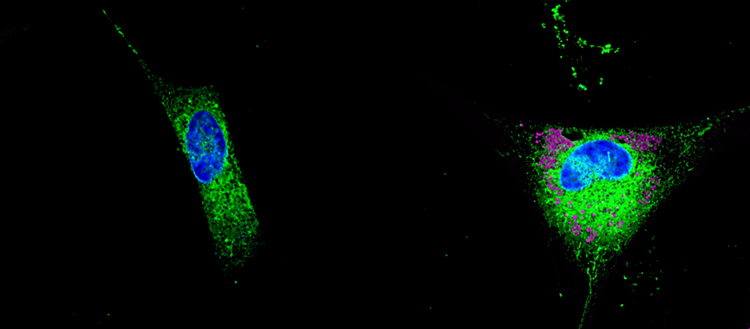
© UNIGE / Anne-Claude Gavin. Un astrocyte stockant des lipides dans les gouttelettes (en rose) et sécrétant des lipides toxiques dans le tissu environnant.
Dans le cerveau, les neurones coexistent avec de nombreux autres types de cellules dont ils dépendent pour fonctionner correctement. Les astrocytes, qui tirent leur nom de leur forme étoilée, assurent la survie des neurones en les nourrissant et en les détoxifiant à l’aide d’une protéine multifonction, APOE. Or, l’une des trois formes de cette protéine, APOE4, augmente considérablement le risque de développer la maladie d’Alzheimer; on ignore cependant les mécanismes à l’œuvre. Une collaboration réunissant l’Université de Genève (UNIGE), le Laboratoire européen de biologie moléculaire (EMBL), l’Université de Zurich et l’entreprise pharmaceutique AbbVie en a découvert le potentiel mécanisme: loin de cesser de fonctionner, APOE4 serait au contraire trop efficace. En déclenchant la sécrétion lipidique des astrocytes, elle provoque l’accumulation de lipides délétères pour les neurones qui contribueraient au développement de la maladie d’Alzheimer. Ces résultats, à découvrir dans la revue Cell Reports, apportent un éclairage nouveau sur les mécanismes neurodégénératifs d’une maladie qui affecte près de 50 millions de personnes dans le monde.
Les astrocytes, présents en très grand nombre dans le cerveau, ont une fonction protectrice majeure. Ces cellules sécrètent en effet l’apolipoprotéine E, ou APOE, une petite protéine qui forme des particules contenant des lipides et des vitamines pour assurer l’alimentation des neurones. Celle-ci assure également leur détoxification, en les débarrassant de leurs déchets lipidiques qui peuvent devenir nocifs s’ils ne sont pas retirés. Les neurones étant incapables d’éliminer seuls ces déchets, APOE entre en jeu pour les collecter et les ramener aux astrocytes où ils sont détruits.
Le gène codant pour APOE existe en trois variants fréquents chez l’être humain: APOE2, présent dans 8% de la population, APOE3, le plus fréquent, et enfin APOE4, que l’on retrouve chez près de 15% des gens et qui multiplie par dix le risque de développer la maladie d’Alzheimer. «Les raisons pour lesquelles APOE4 augmente de manière si importante le risque d’Alzheimer ne sont pas bien comprises», explique Anne-Claude Gavin, professeure ordinaire au Département de physiologie cellulaire et métabolisme de la Faculté de médecine de l’UNIGE et titulaire d’une chaire de la Fondation Louis-Jeantet, qui a dirigé ces travaux avec Viktor Lakics, responsable du Département de biologie pour la découverte des neurosciences chez AbbVie.
«Quels sont les mécanismes à l’origine du dysfonctionnement de APOE4? Et surtout pourraient-ils être la base de nouvelles stratégies de prévention ou de thérapie?» Pour répondre à ces questions, Anne-Claude Gavin et son équipe se sont associées à des scientifiques du Laboratoire européen de biologie moléculaire (EMBL), de l’Université de Zurich et d’AbbVie.
Une protéine trop efficace
L’équipe de recherche a identifié de nouveaux mécanismes moléculaires, qui expliquent comment APOE se lie aux membranes des astrocytes pour y détecter et en extraire les lipides dont elle a besoin. De plus, des expériences in vitro menées sur des lignées cellulaires humaines porteuses des différentes variantes d’APOE ont démontré que cette protéine est extrêmement efficace pour transporter les lipides potentiellement nocifs produits dans les neurones. «Et à notre grande surprise, APOE4 s’est avérée encore plus efficace que les autres formes de la protéine», s’enthousiasme Katharina Beckenbauer, co-première auteure de cette étude, précédemment chercheuse au sein du Laboratoire d’Anne-Claude Gavin et actuellement scientifique senior chez AbbVie. «Ainsi, contrairement à ce que l’on pensait jusqu’ici, le problème n’est pas qu’APOE4 cesse de fonctionner mais l’inverse: le mécanisme s’emballe.»
Une fonction détournée
Lorsque les astrocytes vieillissent, ils deviennent moins efficaces et se mettent à accumuler les lipides plutôt que de les détruire. «Nous avons expérimentalement modélisé ce processus et observé les molécules sécrétées par les astrocytes», explique Karina Lindner, doctorante dans le laboratoire d’Anne-Claude Gavin et co-première auteure de ces travaux. «Nous avons observé que le vieillissement cellulaire détournait APOE de sa fonction première — le transport de lipides vers les neurones et la récupération des déchets lipidiques — vers la sécrétion de triglycérides, un type particulier de lipides qui peuvent devenir néfastes s’ils ne sont pas détruits.» Et ce phénomène est exacerbé avec APOE4: elle stimule la sécrétion de triglycérides, entraînant leur accumulation incontrôlée. Cette accumulation pourrait ainsi grandement contribuer à la mort neuronale, une caractéristique de la maladie d’Alzheimer. «APOE4 présenterait ainsi la capacité d’accélérer le processus pathologique de la maladie.»
Afin de mieux comprendre les détails de l’action d’APOE et surtout de son variant E4, les scientifiques de l’UNIGE veulent maintenant déterminer comment la sécrétion de ces lipides potentiellement nocifs est régulée et si cette sécrétion peut être détectée chez des personnes souffrant de la maladie d’Alzheimer.
