Recherche
Les récepteurs couplés aux protéines G (RCPG) sont des récepteurs membranaires polyvalents qui transforment la liaison de divers ligands extracellulaires en cascades de signalisation intracellulaire. En tant que tels, ils jouent un rôle essentiel dans la physiologie et les maladies humaines et constituent des cibles thérapeutiques de premier plan. Nous cherchons à comprendre comment les RCPG fonctionnent dans le contexte cellulaire et, plus précisément, comment les récepteurs des différents organites cellulaires traduisent la liaison du ligand en résultats de signalisation spécifiques. Nous pensons qu'une meilleure compréhension de la logique spatio-temporelle de la signalisation des RCPG au niveau des cellules individuelles est essentielle pour déterminer la spécificité de l'action des médicaments et peut contribuer au développement de traitements plus sûrs capables de déclencher sélectivement les réponses de signalisation souhaitées.
Projets de recherche en cours
Signalisation des récepteurs à partir de membranes internes
Le modèle classique du fonctionnement des RCPG se concentre sur les événements de signalisation qui se produisent exclusivement au niveau de la membrane plasmique. Ce concept a récemment été remis en question par un ensemble de données émergentes démontrant que certains RCPG émettent des signaux à partir d'organites intracellulaires, ce qui présente un nouveau paradigme en matière de biais de signalisation spatialement encodés. Plusieurs effecteurs en aval, y compris les protéines G et les adénylyl cyclases, sont connus pour être abondants dans les organites intracellulaires. Cependant, les événements précis de signalisation interne restent insaisissables et la façon dont ils affectent les processus physiologiques est en grande partie inconnue.
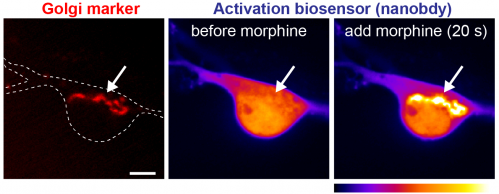
En nous concentrant sur les ligands des récepteurs opioïdes, récepteurs importants d'un point de vue physiologique et pharmacologique, nous avons pu montrer que les médicaments opioïdes (par exemple la morphine) diffèrent des peptides endogènes (par exemple l'endorphine) quant à l'emplacement cellulaire où ils déclenchent l'activation du récepteur. Une possibilité prometteuse est que certains effets spécifiques des médicaments comme les réponses à une utilisation abusive puissent être expliqués par le réservoir cellulaire de récepteurs avec lesquels un certain médicament interagit. Nous cherchons à comprendre comment la signalisation des récepteurs de la membrane plasmique, des endosomes ou de l'appareil de Golgi contribue à l'action des médicaments opioïdes. Pour ce faire, nous combinons la microscopie à fluorescence de cellules vivantes, des biocapteurs à base de nanocorps, des indicateurs de signalisation, des approches génomiques non biaisées et divers outils pharmacologiques.
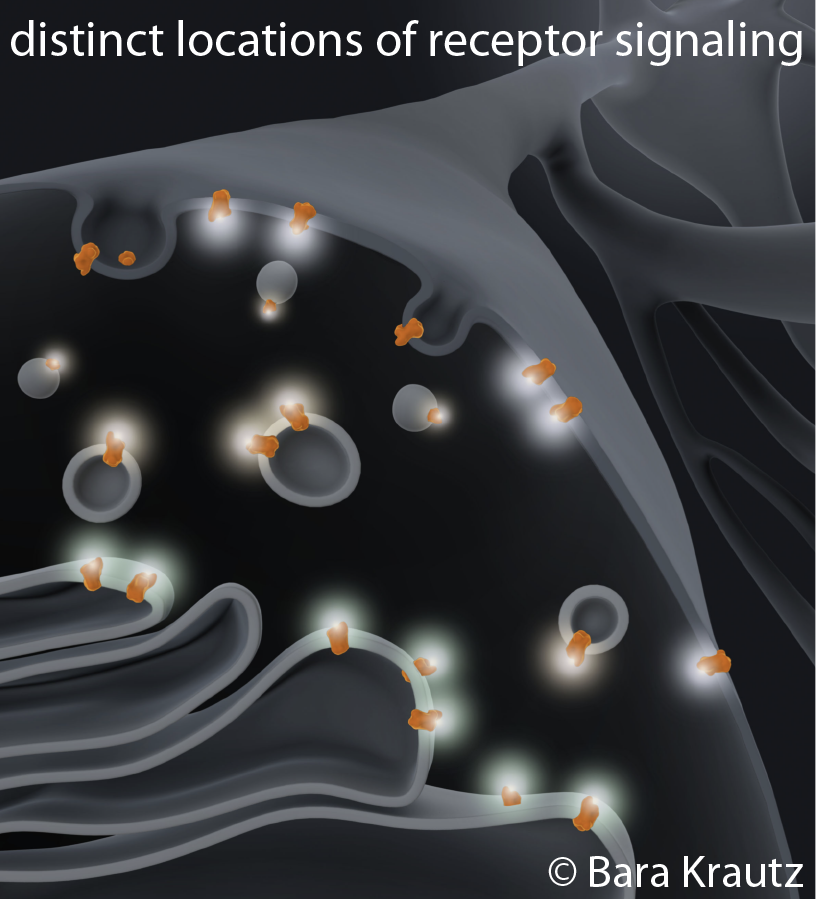
Régulation des réservoirs de récepteurs internes
Qu'est-ce qui régule l'abondance des RCPG dans les organites internes ? Certains RCPG ne sont pas efficacement ciblés à la surface cellulaire et peuvent être bloqués dans la voie de sécrétion. Les quantités différentes de récepteurs dans les organites internes peuvent influencer de manière critique les signaux en réponse à des ligands perméables à la membrane (p. ex. médicaments, hormones). Nous cherchons à identifier les protéines qui régulent le trafic antérograde des GPCRs car elles peuvent être un facteur clé pour comprendre la fonction biologique des réservoirs de récepteurs internes. Nous utilisons une approche de criblage non biaisée et des méthodes biologiques et biochimiques pour comprendre les mécanismes de sortie et de rétention qui régulent le trafic des RCPG.

Nouveaux outils pour percevoir et moduler la fonction des RCPG
Plusieurs études ont maintenant établi l'utilité des anticorps à domaine unique, appelés nanocorps, pour détecter avec une grande précision des protéines cibles dans un environnement cellulaire intact. Les nanocorps exprimés au niveau intracellulaire et marqués par fluorescence peuvent servir de biocapteurs pour détecter la localisation et les changements de conformation des protéines. Cependant, en raison de leurs différents modes de liaison et de leurs affinités, ils peuvent également servir de réactifs pour moduler la fonction de la protéine cible. Nous développons de nouveaux réactifs à base de nanocorps qui ont la capacité de détecter ou de bloquer l'activité des récepteurs et prévoyons de générer des outils efficaces ayant des applications immédiates dans nos propres études sur la signalisation dépendante de l'emplacement. Par ailleurs, nous cherchons à établir une boîte à outils pour sonder la fonction et le trafic des RCPG endogènes avec une grande sensibilité et une résolution subcellulaire dans des tissus biologiques plus complexes. Dans notre travail, nous combinons la biochimie des protéines, les essais basés sur l'imagerie et les techniques de microscopie à haute résolution.