Chasser les microbes ou flairer le poison: une affaire d’évolution
© Carleton - UNIGE
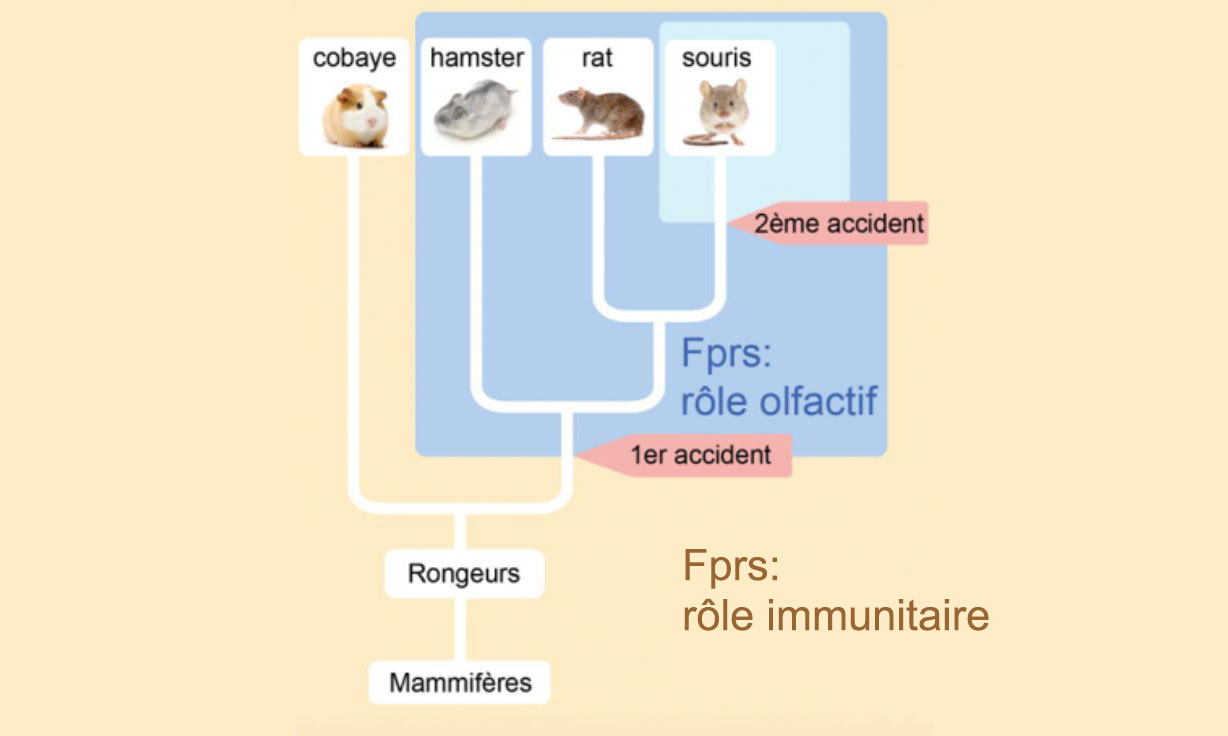
Les mammifères expriment le Fprs dans leurs cellules immunitaires (jaune).
Un premier accident génomique a conduit à l'expression d'un Fpr dans les neurones olfactifs de l'ancêtre d'un rongeur (bleu foncé).
Un deuxième accident s'est ensuite produit dans la lignée de souris (bleu pâle).
Les mammifères possèdent plusieurs lignes de défense contre les microbes. L’une d’entre elles est activée lorsque des récepteurs appelés Fprs présents sur des cellules immunitaires se lient à des molécules spécifiques qui sont relâchées par des agents pathogènes ou produites pour combattre une infection. Des chercheurs de l’Université de Genève (UNIGE) ont montré en 2009 que ces mêmes récepteurs étaient aussi présents dans le nez des souris, probablement pour détecter des aliments contaminés ou éviter des congénères malades. Les biologistes décrivent maintenant dans la revue PNAS comment des Fprs ont acquis ce nouveau rôle, passant du système immunitaire au système olfactif. Les responsables de cette innovation sont deux ‘accidents’ génomiques, survenus à plusieurs millions d’années d’intervalle au cours de l’évolution des rongeurs.
«Nous avons voulu comprendre comment les Fprs ont évolué pour être exprimés à la surface de neurones olfactifs et remplir ainsi une nouvelle fonction», explique Quentin Dietschi, du laboratoire du professeur Ivan Rodriguez au Département de génétique et évolution de la Faculté des sciences de l’UNIGE et co-premier auteur de l’étude, prolongeant la recherche de 2009, déjà menée par le professeur Rodriguez. En collaboration avec Alan Carleton, professeur au Département des neurosciences fondamentales de la Faculté de médecine de l’UNIGE, les biologistes ont démontré que cette innovation génétique était due à deux accidents génomiques survenus au cours de l’évolution des rongeurs. C’est en comparant les séquences d’ADN de diverses espèces de rongeurs actuelles que les chercheurs ont pu remonter dans le temps, les points communs et différences permettant de suivre l’évolution des gènes ciblés.
Des récepteurs immunitaires qui ont du nez
On transmet rarement une copie parfaite de son génome à sa progéniture. Ce sont ces modifications d’une génération à la suivante qui sont parfois à l’origine d’innovations importantes. «Durant l’évolution, un gène codant pour l’un des Fprs s’est retrouvé près d’une séquence d’ADN régulant l’expression d’un récepteur olfactif. Cet élément régulateur a donc été détourné, permettant l’expression du Fpr au détriment de celle du récepteur olfactif d’origine», précise Joël Tuberosa, co-premier auteur de l’article. C’est ainsi que l’ancêtre des hamsters, des rats et des souris actuels a acquis une nouvelle capacité olfactive, probablement celle de flairer des traces de microbes présentes dans son environnement.
Une nouvelle boîte à outils sensorielle
Quelques dizaines de millions d’années plus tard, chez l’ancêtre de la souris, un gène codant pour un Fpr immun s’est à nouveau déplacé près d’un élément régulateur olfactif, mais différent du précédent. Ce petit rongeur a ainsi acquis un outil supplémentaire pour déceler à l’aide de son nez différentes signatures moléculaires liées aux pathogènes.
Cette recherche présente un cas exemplaire décrivant comment, grâce à deux détournements génétiques seulement, une famille de récepteurs s’est reconvertie, passant de senseurs du monde interne à des senseurs du monde qui nous entoure.
Auteur : UNIGE, Département de Communication >
27 juin 2017