Une méthode révolutionnaire pour sélectionner les nanoparticules les plus utiles en médecine
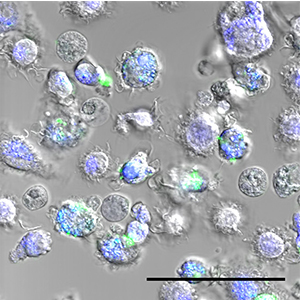
Les nanoparticules, de petits éléments de la taille d’un virus développés en laboratoire, sont de plus en plus utilisées dans le monde biomédical. Cette technologie en plein essor porte l’espoir d’applications médicales diverses, tant dans le domaine du diagnostic que dans une optique thérapeutique. En oncologie, par exemple, les recherches dans le domaine se multiplient et laissent entrevoir des traitements plus ciblés, plus efficaces et moins pénibles pour le patient. Cependant, les interactions de ces nanoparticules avec le système immunitaire étaient jusqu’ici encore mal connues et restaient imprévisibles, limitant de fait l’usage médical qui pourrait en être fait. Ce problème est aujourd’hui en passe d’être résolu: des chercheurs des universités de Genève (UNIGE) et de Fribourg (UNIFR) ont en effet mis au point une méthode permettant de sélectionner très rapidement les nanoparticules les plus prometteuses, accélérant ainsi le développement de futurs traitements. En moins d’une semaine, ils parviennent à déterminer si les nanoparticules qui leur sont soumises sont ou non compatibles avec l’organisme humain, une analyse qui nécessitait auparavant plusieurs mois de travaux. Cette découverte, décrite dans la revue Nanoscale, permet d’envisager le développement rapide, sûr et moins coûteux, de nanotechnologies appliquées à la médecine.
Les nanoparticules ont en commun de mesurer entre 1 et 100 nanomètres (soit environ la taille d’un virus). Leur taille minuscule permet dès lors d’envisager des utilisations médicales variées, telles que jouer le rôle de marqueurs lors d’un examen diagnostique, ou encore livrer une molécule thérapeutique à l’endroit exact du corps où le médicament doit agir. Cependant, pour pouvoir être utilisées dans le domaine médical, les nanoparticules doivent d’abord prouver leur innocuité pour l’organisme humain, tout en étant capables de contourner le système immunitaire pour agir. «Il faut à un laboratoire des années pour développer une nanoparticule, sans savoir quels effets elle aura sur un organisme vivant. Il existait donc un réel besoin de développer une méthode efficace de tri applicable dès le début du processus de mise au point d’un nouveau produit, » explique Carole Bourquin, professeure aux facultés de médecine et des sciences de l’UNIGE, qui a dirigé ces travaux. « En cas de non compatibilité, plusieurs années de recherche étaient tout bonnement à jeter. »
Les macrophages, chefs d’orchestre de l’immunité
Lorsqu’un élément étranger, quel qu’il soit, pénètre dans l’organisme, le système immunitaire s’active. En première ligne, on trouve systématiquement les macrophages, de grosses cellules qui, en « ingérant » les intrus, déclenchent la réponse immunitaire. Les nanoparticules ne font pas exception. Les réactions des macrophages face à la nanoparticule examinée prédisent donc la biocompatibilité du produit. «Il est très difficile, au début du développement d’une nouvelle particule, de s’assurer que la recette est exactement la même à chaque fois, » souligne Inès Mottas, première auteure. « Si on teste des lots différents, les résultats peuvent différer. D’où notre idée de trouver un moyen de tester en même temps, sur le même échantillon, les trois paramètres permettant d’établir la biocompatibilité du produit : sa toxicité, son pouvoir d’activation du système immunitaire, ainsi que la capacité des macrophages à les ingérer.»
La nanoparticule médicale idéale se doit de ne pas être toxique – donc de ne pas tuer les cellules–, de ne pas être totalement ingérée par les macrophages afin de conserver son pouvoir d’action, et de limiter l’activation du système immunitaire pour ne pas induire d’effets indésirables.
Évaluer en même temps trois éléments clés
Jusqu’ici, l’évaluation de la biocompatibilité des nanomatériaux constituait un processus laborieux de plusieurs mois et posait des problèmes de reproductibilité, car tous les tests n’étaient pas menés sur le même lot de particules. Grâce à l’utilisation de la cytométrie en flux, l’équipe de la professeure Bourquin parvient à un diagnostic portant sur les trois éléments essentiels de manière sûre et standardisée, en un temps record. « Les macrophages, mis en contact avec les nanoparticules à étudier pendant 24 heures, défilent ensuite devant des faisceaux laser. La fluorescence émise par les macrophages permet de les compter et de caractériser leur état d’activation. Etant donné que les particules sont elles-mêmes fluorescentes, on peut aussi mesurer la quantité ingérée par les macrophages. Notre procédé nous permet de tester ces trois éléments en même temps, et il suffit de très peu de particules! » indique Inès Mottas. « En deux ou trois jours, nous pouvons établir un diagnostic complet de la nanoparticule qui nous est soumise. »
Le procédé développé à Genève et Fribourg et effectué dans le contexte du centre national de compétences «Bio-Inspired Materials» rencontre déjà un important succès auprès des scientifiques travaillant à la mise au point de nouvelles particules. En leur permettant de sélectionner rapidement les particules les plus prometteuses, cette méthode concentre les efforts, ce qui a également un impact financier sur les coûts de recherche et permet de surcroît de limiter le recours à l’expérimentation animale. Elle ouvre également la voie à un traitement de plus en plus personnalisé de certaines pathologies : en testant les nanoparticules sur des cellules tumorales isolées d’un patient en particulier, par exemple, il serait théoriquement possible d’identifier le traitement le plus efficace pour le patient concerné. A voir si la pratique confirme cette hypothèse.
Contact: Carole Bourquin, 022 379 90 71
3 févr. 2017