Cancer : à l’origine des mutations génétiques
En établissant le lien entre les défaillances de réplication de l’ADN des cellules cancéreuses et leur instabilité génétique, des chercheurs de l’UNIGE mettent au jour un mécanisme de mutation essentiel au développement du cancer.
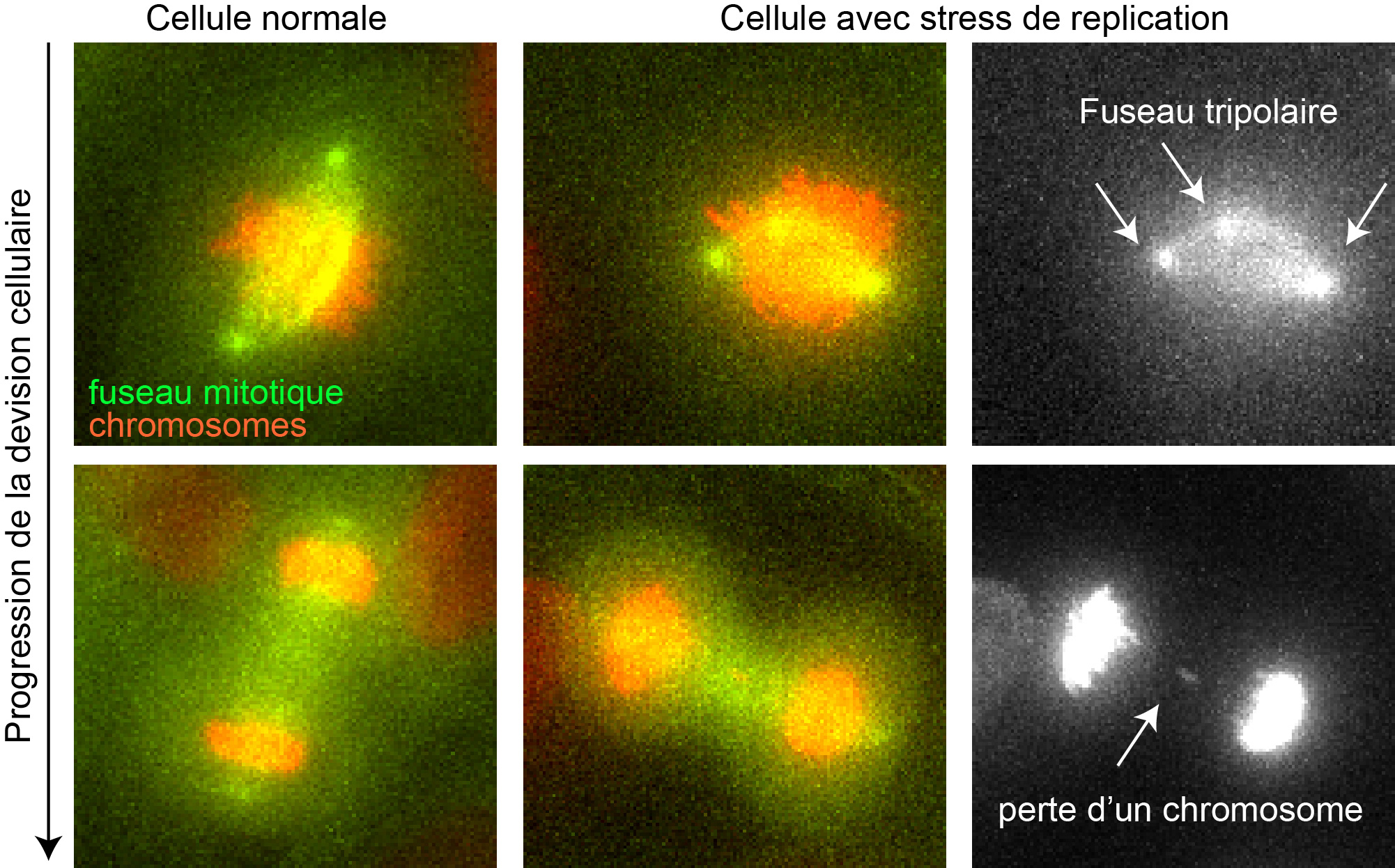
Images de microscopie de fluorescence de la division d’une cellule normale (rangée de gauche) et d’une cellule avec stress de réplication (rangée du millieu). Le fuseau mitotique est en vert, les chromosomes en rouge. La rangée de droite détaille les erreurs de la cellule avec stress de réplication: un fuseau tripolaire (à gauche) et la perte d’un chromosome (à droite). © UNIGE – Patrick Meraldi
Quand une cellule se divise pour donner naissance à deux cellules-filles, elle doit répliquer son ADN selon un scénario très précis. En présence d’éléments perturbateurs, les cellules cancéreuses sont incapables de réaliser cette opération de manière optimale et la réplication se déroule alors plus lentement et de manière moins efficace. Ce phénomène porte le nom de stress de réplication. Si on le savait lié à l’augmentation des mutations génétiques, un autre phénomène typique des cellules cancéreuses, le mécanisme à l’œuvre demeurait inconnu jusqu’ici. En décryptant comment le stress de réplication induit la perte ou le gain de chromosomes entiers chez les cellules-filles des cellules cancéreuses, et en parvenant même à renverser ce phénomène dans ces cellules malades, des chercheurs de l’Université de Genève (UNIGE) apportent de nouvelles connaissances qui permettront à terme de mieux diagnostiquer et peut-être de mieux soigner le cancer. Ces travaux sont à découvrir dans la revue Nature Communications.
Durant un cycle de vie normal, la cellule grandit et lorsqu’elle dispose de tous les «blocs de construction» nécessaires pour la réplication de l’ADN, elle réplique les chromosomes contenant l’information génétique. Une fois que la réplication de l’ADN est terminée, la cellule entre en mitose, un terme qui désigne les étapes gouvernant la division cellulaire. Se crée alors un fuseau mitotique, au sein duquel les deux brins d’ADN répliqués sont séparés pour que les deux cellules-filles héritent d’un nombre identique de chromosomes. «Pour permettre la répartition correcte des chromosomes, le fuseau mitotique dispose de deux pôles, indique Patrick Meraldi, professeur au Département de physiologie cellulaire et métabolisme et coordinateur du centre de recherche translationnelle en onco-hématologie (CRTOH) de la Faculté de médecine de l’UNIGE. Cette bipolarisation est indispensable pour la stabilité génomique des deux cellules-filles.»
La plupart du temps, le stress de réplication est dû à certaines molécules qui, produites en excès, deviennent néfastes. Par exemple, la protéine cycline E, impliquée dans la régulation de l’ADN, favorise l’apparition de cancers lorsqu’elle est surexprimée. Sous son influence, les cellules cancéreuses ont tendance à se répliquer trop tôt. Elles ne disposent alors pas de tous les composants nécessaires à la synthèse de l’ADN et c’est là que les erreurs apparaissent.
Créer et supprimer artificiellement un stress de réplication
Pour décrypter ce phénomène, les chercheurs ont induit artificiellement un stress de réplication dans des cellules humaines saines avec un produit qui ralentit la réplication de l’ADN, et donc empêche le processus de se dérouler normalement. «Nous avons observé que ce stress entraîne une malformation du fuseau mitotique qui, au lieu d’avoir deux pôles, en a trois ou quatre,» explique Therese Wilhelm, chercheuse dans l’équipe du professeur Meraldi et co-première auteure de ces travaux. «La cellule est en général capable de supprimer ces pôles surnuméraires, mais pas suffisamment rapidement pour éviter des connexions erronées entre les chromosomes et le fuseau mitotique.» Au final, ces connexions erronées favorisent une mauvaise distribution des chromosomes, induisant la perte ou le gain d’un ou plusieurs chromosomes. Cette instabilité génétique permet ainsi l’évolution anarchique des cellules cancéreuses.
Les scientifiques ont ensuite réussi à corriger les effets du stress de réplication dans des cellules malades en leur apportant les composants absents dont elles avaient besoin pour la réplication. «Non seulement nous avons établi le lien entre le stress de réplication et les erreurs chromosomiques, mais nous avons été capables de le corriger, montrant ainsi que ce phénomène, présent dans l’ensemble des cellules cancéreuses, et même précancéreuses, est contrôlable,» rapporte Anna-Maria Olziersky, chercheuse dans l’équipe du professeur Meraldi co-première auteure.
Des thérapies exploitant ce phénomène
Grâce à une série d’expériences ciblant ce mécanisme, les chercheurs ont démontré la plus grande sensibilité des cellules au fuseau mitotique anormal au paclitaxel, un médicament chimiothérapeutique agissant sur le fuseau mitotique et utilisé pour le traitement du cancer du sein. «Cela démontre qu’en principe, il est possible de cibler spécifiquement ces cellules sans affecter les cellules saines,» explique Patrick Meraldi. «L’idée n’est pas de corriger l’erreur, mais au contraire de bloquer la cellule à ce stade pour l’empêcher de supprimer les pôles supplémentaires, ce qui entraîne automatiquement sa mort rapide, sans causer de dommage pour les cellules voisine encore saines.»
Ces recherches ont été financées notamment par le Fond national suisse pour la recherche scientifique, la Ligue suisse contre le cancer et la Fondation Ernest-Boninchi. Le CRTOH fait partie du Swiss Cancer Center Léman (SCCL), une alliance pluridisciplinaire réunissant l’UNIGE, les HUG, l’EPFL, le CHUV, l’UNIL et la Fondation ISREC visant à mener des recherches fondamentales, translationnelles et cliniques dans le domaine du cancer.
