La force cachée de nos gardiens cellulaires
Une équipe de l’UNIGE et de l’EPFL montre comment les protéines chaperonnes Hsp70 facilitent le déplacement des protéines à l’intérieur des cellules.
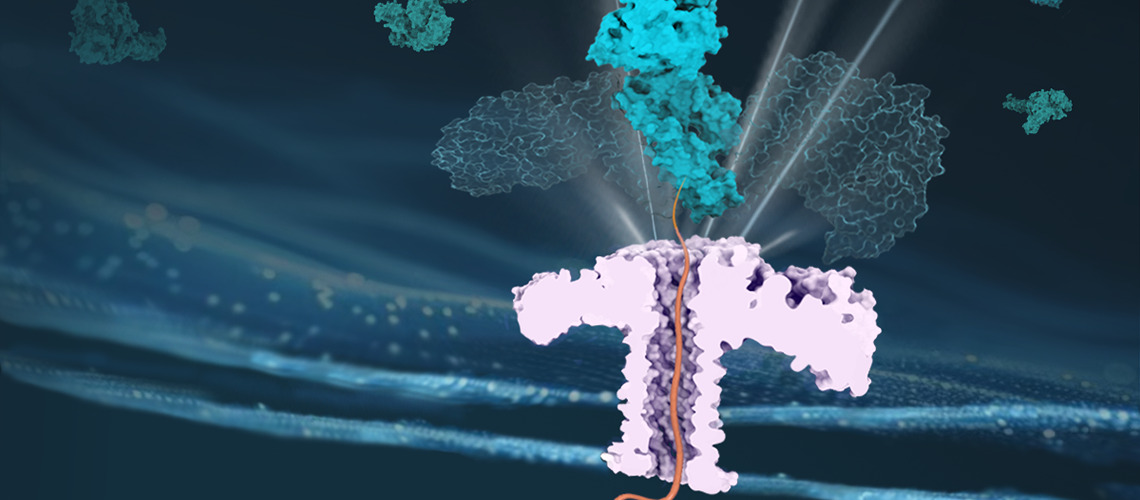
Les protéines contrôlent la plupart des fonctions du corps humain. Leur dysfonctionnement peut ainsi avoir de graves conséquences, comme les maladies neurodégénératives ou le cancer. C’est pourquoi les cellules ont mis en place des mécanismes pour contrôler la qualité des protéines. Dans les cellules animales et humaines, les chaperons de la classe Hsp70 sont au cœur de ce système de contrôle, supervisant un large éventail de processus biologiques. Pourtant, malgré leur rôle crucial, leur mécanisme moléculaire précis restait insaisissable. En utilisant une technique de pointe de nanopore, une équipe de l’Université de Genève (UNIGE), en collaboration avec l’EPFL, vient de faire une percée significative en déterminant comment les Hsp70 génèrent la force nécessaire pour manipuler la structure de leurs protéines clientes. Ces résultats, qui mettent fin à une décennie de débat, sont publiés dans Nature Communications.
Pour fonctionner correctement, les protéines doivent se plier dans des formes tridimensionnelles spécifiques. Les protéines chaperonnes, telles que les Hsp70, contribuent notamment à ce repliement. Pour mener à bien ces tâches, les Hsp70 doivent manipuler avec force la structure des protéines, en les extrayant des agrégats qui se sont formés spontanément ou en les faisant passer à travers des pores étroits, pour les conduire au sein de compartiments cellulaires clés, tels que les mitochondries.
L’équipe a tiré parti de la technologie des nanopores pour reproduire la configuration in vivo de la translocation des protéines.
Au cours des années 1990 et au début des années 2000, le mécanisme permettant aux chaperons Hsp70 d’entraîner la translocation des protéines a fait l’objet d’un débat intense. Deux modèles principaux ont été proposés sur la base de différentes expériences, mais aucune réponse définitive n’a été apportée. En 2006, une nouvelle théorie, appelée Entropic Pulling (Traction Entropique), a été proposée par le professeur Paolo De Los Rios de l’EPFL et le professeur Pierre Goloubinoff de l’Université de Lausanne (UNIL) et leurs collaborateurs et collaboratrices. L’Entropic Pulling pourrait expliquer toutes les observations existantes concernant la translocation des protéines dans les mitochondries. Elle pourrait également s’appliquer aux autres fonctions cellulaires des Hsp70, telles que la désagrégation des protéines.
Preuve expérimentale
Au fil des années, cette théorie a permis d’interpréter un nombre croissant de résultats mais était restée sans confirmation expérimentale directe. Le groupe de Chan Cao, professeure assistante au Département de chimie analytique et minérale de la Faculté des sciences de l’UNIGE, est spécialisé dans la bioanalyse de molécules uniques, en particulier la détection par nanopores. Cette approche innovante consiste à lire la réponse du courant ionique lorsqu’une molécule traverse un pore d’échelle nanométrique. Le pore peut être constitué d’une protéine biologique intégrée dans une membrane lipidique ou dans un matériau à l’état solide fabriqué. Le développement de la technologie des nanopores vise à créer des capteurs à haute résolution pour la détection de molécules cibles dans des matrices complexes et pour le séquençage de polymères.
Dans ce travail récent, l’équipe a tiré parti de la technologie des nanopores pour reproduire la configuration in vivo de la translocation des protéines. La professeure Chan Cao explique: «Nos résultats apportent des preuves évidentes du mécanisme de traction entropique des chaperons Hsp70, écartant les deux autres modèles précédemment proposés, à savoir le Power Stroke et le Brownian Ratchet».
Une force puissante au niveau moléculaire
Dans le mécanisme d’Entropic Pulling, la protéine chaperonne, en tirant sur la protéine cible, augmente ses possibilités de mouvement, générant ainsi une force dite entropique. Verena Rukes, doctorante et première autrice de l’étude, explique : «Notre analyse a estimé la force de traction entropique à environ 46 pN sur une distance de 1 nm, ce qui indique une force remarquablement forte au niveau moléculaire».
Paolo De Los Rios, de l’Institut de physique et de l’Institut de bioingénierie de l’EPFL, poursuit : «Notre théorie proposée en 2006 rendait compte de la majeure partie de la physique du système comprenant Hsp70, la protéine de translocation et le pore de translocation, mais elle restait finalement une théorie, même si elle était en accord indirect avec la plupart des observations. Grâce au magnifique travail de la professeure Chan Cao et de son équipe, nous avons maintenant une preuve directe de cette théorie et, ce qui est le plus important, une estimation quantitative de sa force. Celle-ci s’avère être remarquablement élevée, ce qui explique pourquoi les Hsp70 sont si efficaces pour modifier la structure de leurs protéines cibles».
Par ailleurs, ces travaux établissent la méthode de détection par nanopore comme une technique puissante pour explorer les mécanismes moléculaires de l’action des protéines.
