Principe du microscope électronique à balayage (MEB)
Ce microscope électronique utilise un faisceau d’électrons ponctuel pour « éclairer » l’échantillon. Les caractéristiques des électrons lui permettent d’obtenir des grossissements élevés allant jusqu’à 200’000x avec une netteté excellente.
Comme pour le microscope électronique à transmission l’utilisation d’un faisceau d’électrons implique que la colonne et la chambre dans laquelle se trouve l’échantillon soient sous vide poussé pour que les électrons ne soient pas arrêtés-déviés par les molécules d’air.
Des lentilles électromagnétiques et des diaphragmes focalisent le faisceau sur la surface de l’échantillon. Pour améliorer la qualité des images d’échantillons biologiques leur surface est recouverte d’une fine couche métallique, habituellement de l’or. La pénétration des électrons dans la matière est très faible, surtout après métallisation. On obtient donc une image de la surface de l’échantillon.
Certains échantillons biologiques relativement secs peuvent être observés directement après métallisation sans préparation particulière : graines, grains de pollen… Par contre des échantillons mous ou hydratés nécessitent une préparation : fixation chimique, lavages, déshydratation, séchage et métallisation.
Exemple de protocole de préparation d'échantillons de plantes en vue de leur examen au MEB
Toutes les étapes se déroulent à la t° du laboratoire
● 1ère fixation : glutaraldéhyde 2.5% dans tampon cacodylate de sodium 0.1M (pH 7.0) – 2h
● Lavages : dans tampon cacodylate de sodium 4 x 15 min
● 2ème fixation : OsO4 1% dans tampon cacodylate de sodium 2 heures
● Lavages : Cacodylate de sodium 2 x 15 minutes puis Eau milliQ 2 x 15 minutes
● Déshydratation dans l’éthanol :
Ethanol 30 20 min
Ethanol 50 20 min
Ethanol 70 20 min
Ethanol 90 20 min
Ethanol 100 3 x 20 min
● Point critique
● Métallisation : dépôt d'une couche d’or avec l’appareil « JEOL 1200 - Fine coater » de la plateforme de bioimagerie, Bioimaging
Center de la Faculté des Sciences - Université de Genève.
● Observations : microscope Jeol JSM-6510 LV - Protocole d'utilisation - rédigé en collaboration avec Stéphane Hagmann (auxiliaire de recherche de mai à août 2011).
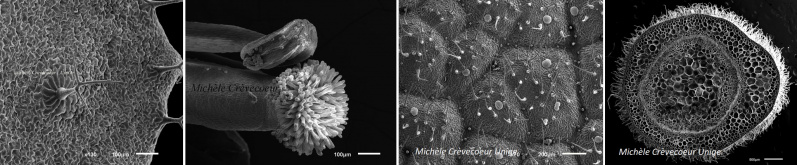
Ci dessous liste des oganes de diverses plantes imagés avec le MEB JEOL JSM 6510LV
Feuilles :
Arabidopsis thaliana
Origanum vulgare
Rosmarinus officinalis
Salvia officinalis
Triticum durum
Drosera linearis
Tige :
Salvia officinalis
Racines:
Zea mays
Embryon:
Arabidopsis thaliana
Fleur :
Arabidopsis
Prises de vue : Stéphane Hagmann (auxiliaire de recherche et de l'enseignement), Kilian Anderegg (apprenti laborant); Michèle Crèvecoeur;
Annotations & commentaires des images : Michèle Crèvecoeur
Retrouver toutes les photos en cliquant ici
Microscopes Electroniques à Balayage à Genève
Dr André Piuz
Muséum d'histoire naturelle de la Ville de Genève
Laboratoires de Microscopie électronique à Balayage et de microanalyse de rayons X
Bioimaging Center
Faculté des Sciences (Sciences II) -Université de Genève
Prof. Rossana Martini
Sciences de la Terre